
分析 (1)BaSO4中含有少量杂质Na2SO4,溶于水过滤即可除去;
(2)洗涤沉淀,利用过滤装置,加蒸馏水浸没沉淀;
(3)证明沉淀是否洗涤干净,检验最后一次的洗涤液是否含硫酸根离子即可.
解答 解:(1)BaSO4中含有少量杂质Na2SO4,为除去杂质,加适量蒸馏水溶解、过滤、洗涤沉淀,故答案为:C;
(2)在漏斗中洗涤沉淀的正确操作为向漏斗中加入蒸馏水至刚好没过沉淀,让水自然流下,重复2~3次,
故答案为:向漏斗中加入蒸馏水至刚好没过沉淀,让水自然流下,重复2~3次;
(3)证明沉淀是否洗涤干净的操作及现象为取少量最后一次洗涤液于小试管中,滴加BaCl2溶液,如果产出白色沉淀,则没洗涤干净;反之,洗涤干净,
故答案为:取少量最后一次洗涤液于小试管中,滴加BaCl2溶液,如果产出白色沉淀,则没洗涤干净;反之,洗涤干净.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、性质差异、混合物分离提纯为解答的关键,侧重分析与应用能力的考查,注意沉淀的洗涤及检验,题目难度不大.


科目:高中化学 来源: 题型:解答题
 某学生探究AgCl、Ag2S沉淀转化的原因.
某学生探究AgCl、Ag2S沉淀转化的原因.| 步 骤 | 现 象 |
| Ⅰ.将NaCl与AgNO3溶液混合 | 产生白色沉淀 |
| Ⅱ.向所得固液混合物中加Na2S溶液 | 沉淀变为黑色 |
| Ⅲ.滤出黑色沉淀,加入NaCl溶液 | 较长时间后,沉淀变为乳白色 |
| 现象 | B.一段时间后,出现白色沉淀 |
| C.一点时间后,无明显变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验序号 | 温度 | 0min | 10min | 20min | 30min | 40min | 50min | 60min |
| 1 | 820℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 820℃ | c1 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800℃ | c2 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 800℃ | 1.0 | 0.20 | 0.20 | 0.20 | 0.20 | 0.20 | 0.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | HCl、H2SO4、NH3•H2O | B. | NaOH、HCl、H2SO4 | ||
| C. | HCl、H2SO4、NaOH | D. | HCl、NaOH、H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
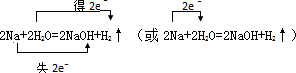 .反应中若产生0.2mol的气体,则有0.4mol的电子转移.
.反应中若产生0.2mol的气体,则有0.4mol的电子转移.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com