
【题目】元素周期表的一部分如图所示,W、X、Y、Z均为短周期主族元素,X与Z的最高正价之和与W的相等。下列说法错误的是
![]()
A.原子半径:X>Y>Z>W
B.X2W2中含有离子键和共价键
C.Y的最高价氧化物对应的水化物难溶于水
D.将由X、Z的单质组成的混合物放入冷水中,Z的单质不发生反应
【答案】D
【解析】
设X的最外层电子数为x,则Z和W的最外层电子数为(x+2)、(x+3),由X与Z的最高正价之和与W的相等可得,x+(x+2)=x+3,解得x=1,由此可知X为Na元素、Y 为Mg元素、Z为Al元素、W为C元素。
A.同周期元素,从左到右原子半径依次减小,同主族元素,从上到下原子半径依次增大,则原子半径:X>Y>Z>W,故A正确;
B. X2W2为Na2C2,Na2C2中含有离子键和共价键,故B正确;
C. Y 为Mg元素,氢氧化镁为难溶于水的氢氧化物,故C正确;
D. 将由Na、Al的单质组成的混合物放入冷水中,钠首先和水反应生成氢氧化钠和氢气,反应生成的氢氧化钠和铝单质反应生成偏铝酸钠和氢气,故D错误;
故选D。


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
【题目】25 ℃时,用0.1 mol·L-1 NaOH溶液滴定20 mL 0.1 mol·L-1 HX溶液,溶液的pH随加入的NaOH溶液体积的变化如图所示。下列说法不正确的是( )
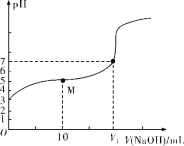
A.HX为弱酸
B.V1<20
C.M点溶液中离子浓度由大到小的顺序:c(X-)>c(Na+)>c(H+)>c(OH-)
D.0.1 mol·L-1 NaOH溶液和0.1 mol·L-1 HX溶液等体积混合后,溶液中c(Na+)=c(X-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如右图所示.则下列离子组在对应的溶液中一定能大量共存的是

A. a点对应的溶液中:Na+、OH-、SO42-、NO3-
B. b点对应的溶液中:Al3+、Fe3+、NO3-、Cl-
C. c点对应的溶液中:Na+、Ca2+、NO3-、Cl-
D. d点对应的溶液中:Cl-、NO3-、Fe2+、Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.10 molL-1NH3H2O标准溶液滴定20 mL0.10 molL-1盐酸与未知浓度CH3COOH的混合溶液,混合溶液的相对导电能力变化曲线如图所示,已知Kb(NH3·H2O) =Ka(CH3COOH)。下列叙述错误的是
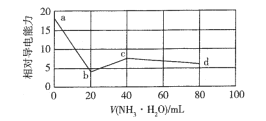
A.H+的导电能力大于等浓度的NH4+
B.a点混合溶液中c( CH3COO- ) +c( CH3COOH) =0.10 molL-1
C.b点混合溶液中,c( NH4+ ) +c( NH3H2O) >c( CH3COOH)
D.c点混合溶液中,c(NH4+) >c(Cl-) >c(CH3COO-) >c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醛( HCHO)在化工、医药、农药等方面有着广泛的应用。
(1)甲醇脱氢法可制备甲醛,同时生成副产物CO等,已知以下热化学方程式:
CH3OH(1) ![]() HCHO(g) +H2(g) △H1= +129.8kJmol-1 (I)
HCHO(g) +H2(g) △H1= +129.8kJmol-1 (I)
CH3OH(g) ![]() CO(g) +2H2(g) △H2= +94.6kJmol-1(II)
CO(g) +2H2(g) △H2= +94.6kJmol-1(II)
CH3OH(1) ![]() CO(g) +2H2(g) △H3= +127.9 kJmol-1 (III)
CO(g) +2H2(g) △H3= +127.9 kJmol-1 (III)
①CH3OH(g) ![]() HCHO(g) +H2(g) △H4=_______kJmol-1(IV)
HCHO(g) +H2(g) △H4=_______kJmol-1(IV)
②650°C条件下,Na2CO3固体催化甲醇脱氢,是自由基引发的链反应,甲醇在Na2CO3表面上先吸附,然后发生分解,生成·H和·CH2OH或CH3O·自由基,自由基再从催化剂表面脱附、脱氢生成HCHO和CO,·H自由基相互结合成H2。已知:C—H键键能为413 kJ·mol-1;O—H键键能为463kJ·mol-1,试将可能性较大的转化过程补充完整:
CH3OH=·H+·CH2OH或CH3OH=·H + CH3O·;
_____=____+ HCHO;
________=3_______+ CO;
·H+·H=H2;
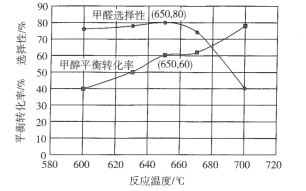
③反应温度对该反应的影响如图所示,从图中可以看出随着反应温度的升高,甲醇平衡转化率逐渐增加,这是因为__________;温度高于650℃,甲醛选择性迅速降低,原因是___________。按只发生反应( II )和( IV)两个平行反应,在650℃平衡时体系总压强为p,则该温度下反应(IV)的压强平衡常数Kp=__________(列出算式即可)。
(2)市售甲醛溶液含量的测定方法如下(已知:HCHOO+ H2O2=HCOOH + H2O、HCOOH + NaOH=HCOONa + H2O):
①向盛有10mL水的锥形瓶中滴入mg甲醛溶液样品,加过氧化氢溶液25mL(过量)与溴麝香草酚蓝指示液2滴,再加入1 molL-1氢氧化钠溶液25 mL,剩余的NaOH用1 molL-1盐酸滴定至溶液显黄色,消耗盐酸V1mL。
②空白实验:向盛有10mL水的锥形瓶中加过氧化氢溶液25mL与溴麝香草酚蓝指示液2滴,再加入1molL-1氢氧化钠溶液25mL,用1molL-1盐酸滴定至溶液显黄色,消耗盐酸V2mL。则甲醛溶液样品中甲醛的质量分数为______(用含m、V1、V2的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置中同时通入a、b两种气体,瓶中实验现象错误的是
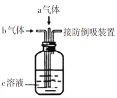
选项 | a气体 | b气体 | c溶液 | 实验现象 |
A | Cl2(1mol) | SO2(1mol) | 品红溶液 | 溶液颜色变浅或褪色 |
B | H2S | SO2 | 水 | 产生淡黄色沉淀 |
C | SO2 | NO2 | BaCl2溶液 | 产生白色沉淀 |
D | NO | O2 | 滴加少量酚酞的NaOH溶液 | 溶液颜色变浅或褪色 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关图像的结论正确的是
图像 | 结论 | |
A |
| 相同质量锌粉分别与1 mol/L盐酸及相同体积未知浓度的盐酸反应,未知浓度盐酸的浓度低于1 mol/L |
B |
| 一定条件下,金刚石转化为石墨要释放能量,金刚石要比石墨稳定 |
C |
| 该装置为化学能转化为电能的装置,且Mg作负极 |
D |
| 一定条件下,某可逆反应的正反应速率和逆反应速率随时间变化曲线如图,反应开始时刻生成物的浓度不为0 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在酸性溶液中,碘酸钾(KIO3)和Na2SO3可发生如下反应:2![]() +5
+5![]() +2H+=I2+5
+2H+=I2+5![]() +H2O,生成的碘可以用淀粉溶液检验,根据溶液出现蓝色所需的时间来衡量该反应的速率。某学生设计实验如下表所示(表格中体积单位均为mL):
+H2O,生成的碘可以用淀粉溶液检验,根据溶液出现蓝色所需的时间来衡量该反应的速率。某学生设计实验如下表所示(表格中体积单位均为mL):
0.01mol/LKIO3溶液的体积 | 某浓度的Na2SO3溶液的体积 | H2O的体积 | 实验温度/℃ | 溶液出现蓝色所需时间 | |
实验1 | 5 | 5 | V1 | 0 | a |
实验2 | 5 | 5 | 20 | 25 | b |
实验3 | 5 | V2 | 15 | 25 | c |
(1)V1=______ mL,V2=______ mL。
(2)如果研究浓度对反应速率的影响,使用实验__________和实验__________。
(3)对比实验1和实验2,可以研究__________对化学反应速率的影响。
(4)溶液出现蓝色所需的时间从多到少的顺序是__________(用a、b、c表示)。
(5)已知反应:2Na2SO3(aq)+O2(aq)=2Na2SO4(aq)。在291.5K时,1.0 L溶液中Na2SO3初始量为10 mmol(1 mol=103 mmol),每5s记录一次溶解氧浓度,一段时间后实验结果如曲线,求0-40s内Na2SO
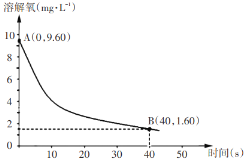
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝热反应是铝的一个重要性质,该性质用途十分广泛,不仅被用于焊接钢轨,而且还常被用于冶炼高熔点的金属如钒、铬、锰等。

(1)某校化学兴趣小组同学,取磁性氧化铁按教材中的实验装置(如图甲)进行铝热反应,现象很壮观。指明使用镁条和氯酸钾的目的是___________________。
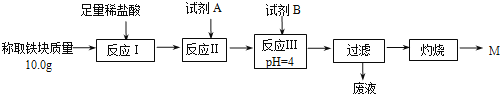
(2)某同学用图乙装置进行铝热反应。取反应后的“铁块”溶于盐酸,向其中滴加KSCN溶液,溶液未见红色。为测定该实验所得“铁块”中铁元素含量,设计实验流程如图所示。
几种氢氧化物开始沉淀和完全沉淀的pH如下表所示。
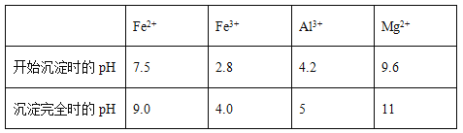
① 试剂A应选择________,试剂B应选择_______(填序号)。
A.稀盐酸 B.氧化铁 C.H2O2溶液 D.氨水
② 写出反应Ⅱ的离子方程式____________________________。
③ 设计简单实验证明M的成分是Fe2O3而非Fe3O4__________。

④ 上述实验应灼烧至M质量不变,则能证明M质量不变的标志是_______。
⑤ 若最终红色粉未M的质量为12.0 g,则该“铁块”的纯度是_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com