
| A. | △H<0表示放热反应,△H>0表示吸热反应 | |
| B. | 如果反应物所具有的总能量小于生成物所具有的总能量,则发生的反应是放热反应 | |
| C. | 在稀溶液中1mol酸和1mol碱完全反应所放出的热量,叫做中和热 | |
| D. | 1 mol H2与0.5 mol O2反应放出的热就是H2的燃烧热 |
分析 A.焓变△H>0表示吸热反应,△H<0,表示放热反应;
B.放热反应中反应物所具有的总能量大于生成物所具有的总能量;
C.中和热的本质是在稀溶液中,1mol氢离子与1mol氢氧根反应,生成1mol水放出的热量;
D.燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量;
解答 解:A.焓变△H>0表示吸热反应,△H<0,表示放热反应,故A正确;
B.如果反应物所具有的总能量大于生成物所具有的总能量,则发生的反应是放热反应,故B错误;
C.中和热是强酸与强碱的稀溶液发生中和反应生成1mol水时放出的热量,则在稀溶液中1mol酸和1mol碱完全反应不一定生成1mol水,故C错误;
D.1 mol H2与0.5 mol O2反应生成液态水放出的热就是H2的燃烧热,故D错误.
故选A.
点评 本题考查热化学方程式,中和热,燃烧热,注意中和热必须是酸和碱的稀溶液,1mol氢离子与1mol氢氧根反应,生成1mol水.


 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 一小块钾投入冷水中:K+2H2O═K++2OH-+H2↑ | |
| B. | 氯气通入碘化钠溶液中:2I-+Cl2═I2+2Cl- | |
| C. | 稀硫酸滴在铁片上:2Fe+6H+═2Fe3++3H2↑ | |
| D. | 氯气通入氯化亚铁溶液中:Fe2++Cl2═Fe3++2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
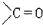 +RMgX→
+RMgX→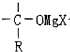
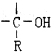

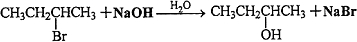 ,
, .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | 1 | 2 | 3 | 4 | 5 |
| 现象 | 微亮 | 亮 | 很亮 | 复燃 | 复燃 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2,100 mL | B. | O2,200 mL | C. | N2,400 mL | D. | CH4,600 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K能从LiCl的溶液中置换出Li | |
| B. | 随着原子序数的递增,单质与水反应的剧烈程度减弱 | |
| C. | 随着原子序数的递增,单质熔点逐渐降低 | |
| D. | Cs2CO3受热易分解 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com