
����Ŀ�������������һ�����Ƴ���������ҩ����ɰ�����(![]() )�ͼ״���Ӧ�Ƶá����������գ�
)�ͼ״���Ӧ�Ƶá����������գ�
(1)д������������Ľṹ��ʽ��_______________________________��
(2)��ҵ����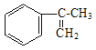 �����IJ���ͬ���͵ķ�Ӧ�Ƶð����ᡣ�밴ʵ�ʽ��еķ�Ӧ˳��д��ָ����Ӧ����������Ҫ���Լ��ͷ�Ӧ������
�����IJ���ͬ���͵ķ�Ӧ�Ƶð����ᡣ�밴ʵ�ʽ��еķ�Ӧ˳��д��ָ����Ӧ����������Ҫ���Լ��ͷ�Ӧ������
��һ��________________________________�� �ڶ���________________________________��
(3)д�����IJ���Ӧ�Ļ�ѧ����ʽ_______________________________________________��
(4)A�DZ� ������̼ԭ�ӵ�һ��ͬϵ���A������̼ԭ�ӿ��Դ���ͬһƽ���ϡ�д��A�Ľṹ��ʽ________________________________��
������̼ԭ�ӵ�һ��ͬϵ���A������̼ԭ�ӿ��Դ���ͬһƽ���ϡ�д��A�Ľṹ��ʽ________________________________��
(5) ![]() �ǰ����������ij��ͬ���칹���һ�ȴ��������������������Һ���ȣ����ɵ��л�����Ľṹ��ʽΪ_____________________________________��
�ǰ����������ij��ͬ���칹���һ�ȴ��������������������Һ���ȣ����ɵ��л�����Ľṹ��ʽΪ_____________________________________��
���𰸡�![]() Br2��CCl4��Һ������ˮ�� NaOHˮ��Һ������
Br2��CCl4��Һ������ˮ�� NaOHˮ��Һ������ 
![]()
![]() +H2O
+H2O ![]()
![]() ��CH2=CH-COONa
��CH2=CH-COONa
��������
����������ǰ�����ͼ״�����������Ӧ�õ��ģ������Ậ��̼̼˫�����Ȼ����ںϳɹ�����Ҫע�Ᵽ��̼̼˫�����ݴ˻ش���Ŀ��
(1)�������������������ṹ��ʽΪ![]() ��
��
(2)��ҵ���� �����IJ���ͬ���͵ķ�Ӧ�Ƶð����ᣬ�ṹ�к���̼̼˫�����ʷ�ӦҪ��˫�����������ֳ������������Ʒ�ԭ������Ӧ���̿����ǰ���������ˮ��Ӧ������
�����IJ���ͬ���͵ķ�Ӧ�Ƶð����ᣬ�ṹ�к���̼̼˫�����ʷ�ӦҪ��˫�����������ֳ������������Ʒ�ԭ������Ӧ���̿����ǰ���������ˮ��Ӧ������ ������������ˮ��Һ��Ӧ����ԭ��ȡ��Ϊ�ǻ������������ص�ǿ��������Ӧ��-CH2OH����Ϊ�Ȼ������Ũ���ỷ��������ȥ��Ӧ��̼̼˫���ع顣��һ��ΪBr2��CCl4��Һ������ˮ���� �ڶ���NaOHˮ��Һ�����ȣ����IJ���Ӧ�Ļ�ѧ����ʽΪ
������������ˮ��Һ��Ӧ����ԭ��ȡ��Ϊ�ǻ������������ص�ǿ��������Ӧ��-CH2OH����Ϊ�Ȼ������Ũ���ỷ��������ȥ��Ӧ��̼̼˫���ع顣��һ��ΪBr2��CCl4��Һ������ˮ���� �ڶ���NaOHˮ��Һ�����ȣ����IJ���Ӧ�Ļ�ѧ����ʽΪ
![]()
![]() +H2O��
+H2O��
(4)AΪ ��һ��ͬϵ���A������̼ԭ�ӿ��Դ���ͬһƽ���ϣ�˵�������2��̼ԭ���벻���ͼ�������A�Ľṹ��ʽΪ
��һ��ͬϵ���A������̼ԭ�ӿ��Դ���ͬһƽ���ϣ�˵�������2��̼ԭ���벻���ͼ�������A�Ľṹ��ʽΪ![]() ��
��
(5) ![]() ����������������Һ���ȣ�̼�ȼ�����ˮ�ⷴӦ�������ǻ�����������ˮ�ⷴӦ�������ϲ����ķ��ǻ��������������Ʒ�Ӧ�����ɵ��л�����Ľṹ��ʽΪ
����������������Һ���ȣ�̼�ȼ�����ˮ�ⷴӦ�������ǻ�����������ˮ�ⷴӦ�������ϲ����ķ��ǻ��������������Ʒ�Ӧ�����ɵ��л�����Ľṹ��ʽΪ![]() ��CH2=CH-COONa��
��CH2=CH-COONa��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�����£�Ksp(AgCl)��1.6��10��10������������ȷ���� ( )
A��AgCl�ڱ���NaCl��Һ�е�Ksp���ڴ�ˮ�е�С
B��AgCl������Һ��c��Cl-��=4��10-5.5mol/L
C����0.001 mol��L��1AgNO3��Һ����0.001 mol��L��1��KCl����������
D����AgCl������Һ�м���NaBr��Һ����ɫ����ת��Ϊ����ɫ��˵��Ksp(AgCl)<Ksp(AgBr)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ȼ��ⱥ��ʳ��ˮ��ȡNaOH�Ĺ�������ʾ��ͼ���£�
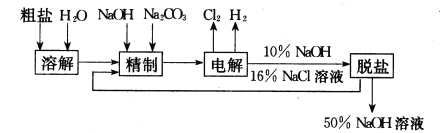
������ͼ�����������գ�
(1)�ڵ������У����Դ���������ĵ缫����������ӦʽΪ__________�� ���Դ���������ĵ缫��������ҺpH ________��ѡ����䣬�����½�����
(2)��ҵʳ�κ�Ca2+��Mg2+�����ʣ����ƹ��̷�����Ӧ�����ӷ���ʽΪ___________��
(3)���������SO42-�����ϸߣ��������ӱ��Լ���ȥSO42-���ñ��Լ�������______��
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
(4)Ϊ��Ч��ȥCa2+��Mg2+��SO42-�������Լ��ĺ���˳��Ϊ _________��
a. �ȼ�NaOH�����Na2CO3���ټӱ��Լ�
b. �ȼ�NaOH����ӱ��Լ����ټ�Na2CO3
c. �ȼӱ��Լ������NaOH���ټ�Na2CO3
(5)���ι���������NaOH��NaCl���ܽ���ϵIJ��죬ͨ��________����ȴ��_________(��д��������)��ȥNaCl��
(6)�ڸ�Ĥ�����ʳ��ˮʱ�����۷ָ�Ϊ������������������ֹCl2��NaOH��Ӧ��������Ĥ�������ʳ��ˮʱ��Cl2��NaOH��ֽӴ�����������NaClO��H2����Ӧ�Ļ�ѧ����ʽΪ_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������A��B����������֪A�ķ���ʽΪC5Hm����B�����ʽΪC5Hn��m��n��Ϊ������������ش��������⣺
��1�����й�����A����B��˵������ȷ���� ������ţ���
a����A����B���ܻ�Ϊͬϵ��
b����A����B���ܻ�Ϊͬ���칹��
c����m=12ʱ����Aһ��Ϊ����
d����n=11ʱ����B���ܵķ���ʽ��2��
��2������AΪ�������ҷ���������̼ԭ�Ӷ���ͬһ��ֱ���ϣ���A�Ľṹ��ʽΪ ��
��3������AΪ�������ҷ���������̼ԭ��һ�����棬��һ�������£�1mol A������1mol H2�ӳɣ���A�������� ��
��4������BΪ����ͬϵ�ȡһ��������B��ȫȼ�պ���������ͨ��������Ũ���ᣬŨ�������������1.26g����ͨ�������ļ�ʯ�ң���ʯ�ҵ���������4.4g������B�ķ���ʽΪ �����䱽���ϵ�һ�����ֻ��һ�֣�����ϴ���������B�� �֡�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ݵ�����Դ����������Ṥҵ���û�����(��Ҫ�ɷ�ΪFeS2)��Ϊԭ�ϡ����������գ�
(1)��0.050mol SO2(g) ��0.030mol O2(g) ����һ��2L���ܱ������У���һ�������·�����Ӧ��2SO2(g)+O2(g)2SO3(g)+Q����2���ӷ�Ӧ�ﵽƽ�⣬���n(SO3)=0.040mol����O2��ƽ����Ӧ����Ϊ______
(2)���ݻ�����ʱ�����д�ʩ�����������SO2ƽ��ת���ʵ���______(ѡ����)
a.�Ƴ����� b.�����¶�
c.��Сѹǿ d.�ٳ���0.050molSO2(g)��0.030molO2(g)
(3)����ʼ�¶�T1(673K)ʱSO2��ת�����淴Ӧʱ��(t)�ı仯��ͼ������ͼ�л�������������������£���ʼ�¶�ΪT2(723K)ʱSO2��ת�����淴Ӧʱ��仯��ʾ��ͼ___

(4)��������һ�����������յIJ���ΪSO2��Fe3O4
�ٽ�����������ղ���Fe3O4����H2SO4�������ۣ����Ʊ�FeSO4�����ܹ�������ά����Һ���㹻�����ԣ���ԭ����______
��FeS2�ܽ���Һ�е�Fe3+��ԭΪFe2+������������ΪSO42����д���йص����ӷ���ʽ______����2mol������������ʱת�Ƶĵ�����Ϊ______
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��ijԪ��ԭ�ӹ���3���۵��ӣ�����һ���۵���λ�ڵ����ܲ�![]() �ܼ������ܲ���______��ԭ�ӹ������Ԫ�ػ�̬ԭ�ӵļ۵����Ų�ͼΪ______��
�ܼ������ܲ���______��ԭ�ӹ������Ԫ�ػ�̬ԭ�ӵļ۵����Ų�ͼΪ______��
��2��![]() ��
��![]() ��Ϊ�����ڽ���Ԫ�ء������±����ݣ�д��
��Ϊ�����ڽ���Ԫ�ء������±����ݣ�д��![]() ԭ�ӵĺ�������Ų�ʽ��______��
ԭ�ӵĺ�������Ų�ʽ��______��
������/ |
|
|
|
|
A | 932 | 1821 | 15390 | 21771 |
B | 738 | 1451 | 7733 | 10540 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л���E�ĺϳ�·����ͼ��
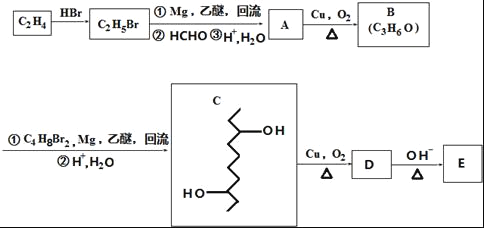
��֪��
��
��
���������գ�
��1��B�й����ŵ�����Ϊ_____��C2H4����C2H5Br�ķ�Ӧ����Ϊ____��
��2��C�ķ���ʽΪ_____��
��3������C2H5Br�����к�����ԭ�ӵ�ʵ�鷽��Ϊ____��
��4��E�Ľṹ��ʽΪ![]() ��D��һ��������ת��ΪE�Ĺ����л������������־�����Ԫ���ṹ�ĸ����д�������ָ�����ṹ��ʽ_____��
��D��һ��������ת��ΪE�Ĺ����л������������־�����Ԫ���ṹ�ĸ����д�������ָ�����ṹ��ʽ_____��
��5��д��һ�����������������л���Ľṹ��ʽ_____
�ٷ���ʽֻ��E��2����ԭ��
����FeCl3������ɫ��Ӧ
�۷����к���4�ֲ�ͬ��ѧ��������ԭ�ӣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����С��ֱ�����ͼ��ʾװ�ö�ԭ��غ͵��ԭ������ʵ��̽����
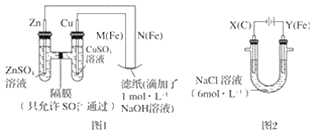
��ش�
����ͼ 1 ��ʾװ�ý��е�һ��ʵ�顣
��1���ڱ�֤�缫��Ӧ���������£�������� Cu ���缫����__������ĸ��ţ���
A �� B ʯī C �� D ��
��2��N ��������Ӧ�ĵ缫��ӦʽΪ__��
����ͼ 2 ��ʾװ�ý��еڶ���ʵ�顣ʵ������У��۲쵽���һ��ʵ�鲻ͬ�����������������������Y������Һ����Ϻ�ɫ��ֹͣʵ�飬���缫���Ա�ϸ�����Һ��Ȼ���塣 �������ϵ�֪������������ӣ�FeO42-������Һ�г��Ϻ�ɫ��
��3���������У�X ������Һ�� pH__����������������С����������������
��4���������У�Y �������ĵ缫��Ӧ֮һΪ Fe��6e��+8OH��= FeO42-+4H2O ���� X ���ռ���672 mL ���壬�� Y ���ռ��� 168 mL ���壨��������Ϊ��״��ʱ������������� Y �缫�����缫����������____g��
��5���ڼ���п����У��ø��������Ϊ�������ϣ���ط�ӦΪ 2K2FeO4+3Z=Fe2O3+ZnO+2K2ZnO2���õ�����������ķ�Ӧ�ĵ缫��ӦʽΪ__��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧ����0.2 mol��L-1������������Һ�ζ�δ֪Ũ�ȵ�������Һ��������ɷֽ�Ϊ���¼�����
A����ʽ�ζ���ȷ��ȡ25.00mL����������Һע��ྻ����ƿ�У�������2~3�η�̪��Һ
B���ñ�����������Һ��ϴ�ζ���2~3��
C����ʢ�б�����������Һ�ļ�ʽ�ζ��̶ܹ��ã����ڵζ��ܼ���ʹ֮������Һ
D��ȡ������������Һע���ʽ�ζ�������0���̶�����2~3mL��
E������Һ������0����0���̶����£����¶���
F������ƿ���ڵζ��ܵ����棬�ñ�����������Һ�ζ����յ㲢���µζ��ܵĶ���
�ش��������⣺
(1)��ȷ�IJ���˳���ǣ�B��_______________��F������ţ�
(2)�ζ�������£�
NaOH��ʼ���� | NaOH�յ���� | |
��һ�� | 0.10mL | 18.60mL |
�ڶ��� | 20.20mL | 38.80mL |
�����������ݿ��Լ������������ʵ���Ũ��Ϊ_______________mol��L-1. ��������С���������λ��Ч���֣�
(3)�ﵽ�ζ��յ�ı�־��________________________________
(4)���²�����ɲⶨ���ƫ�ߵ�ԭ�������___________________��
A. ȡ����Һʱ��δ�ô���ҹ��ϴ��ʽ�ζ���
B. �ζ�ǰ����ʱ�����ӵζ��ܵĿ̶ȣ�������������ȷ
C. �ζ��ܵζ�ǰ�����ݣ��ζ���������
D. �ζ����յ����ʱ���ֵζ��ܼ��촦����һ����Һ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com