
【题目】向15 g铁和氧化铁的混合物中,加入200mL稀盐酸,在标准状况下放出氢气1.68 L,同时铁和氧化铁均无剩余;向溶液中滴加硫氰化钾溶液后,未见颜色变化。为了中和过量的盐酸,而且使Fe2+恰好完全转化成Fe(OH)2,共消耗2mol/L的NaOH溶液300 mL.
(1)生成氢气的质量为________g.
(2)加入300 mL NaOH溶液,反应后,溶液中的溶质主要是___________(填写化学式)。如不考虑混合后溶液体积变化,该溶质的物质的量浓度为__________.
(3)原盐酸中溶质的物质的量浓度是________________.
(4)原混合物中有铁__________g.
【答案】 0.15g NaCl 1.2 mol/L 3 mol/L 7g
【解析】(1)氢气的物质的量是1.68L÷22.4L/mol=0.075mol,因此生成氢气的质量为0.075mol×2=0.15g;(2)加入300 mL NaOH溶液反应后,亚铁离子转化为氢氧化亚铁沉淀,溶液中的溶质主要是NaCl。根据钠离子守恒可知氯化钠的物质的量等于氢氧化钠的物质的量,为0.3L×2mol//L=0.6mol,如不考虑混合后溶液体积变化,该溶质的物质的量浓度为0.6mol÷0.5L=1.2mol/L;(3)根据氯原子守恒可知原盐酸中溶质的物质的量是0.6mol,浓度是0.6mol÷0.2L=3.0mol/L;(4)向溶液中滴加硫氰化钾溶液后,未见颜色变化,这说明溶液中全部是亚铁离子,其中与盐酸反应放出氢气消耗铁的物质的量是0.075mol,质量是0.075mol×56g/mol=4.2g。根据方程式Fe2O3+6H+=2Fe3++3H2O、2Fe3++Fe=3Fe2+可知关系式为Fe~Fe2O3,所以氧化铁的物质的量是![]() ,则原混合物中铁的物质的量是0.075mol+0.05mol=0.125mol,质量是0.125mol×56g/mol=7g。
,则原混合物中铁的物质的量是0.075mol+0.05mol=0.125mol,质量是0.125mol×56g/mol=7g。


科目:高中化学 来源: 题型:
【题目】反应A(g)+B(g)C(g)+D(g)发生过程中的能量变化如图,△H 表示反应的焓变.下列说法正确的是( ) 
A.反应体系中加入催化剂,反应速率增大,E1减小,E2增大
B.反应体系中加入催化剂,反应速率增大,△H不变
C.△H<0,反应达到平衡时,升高温度,A的转化率增大
D.△H>0,反应达到平衡时,升高温度,A的转化率减少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】精确配制一定物质的量浓度的溶液通常有两种方法:直接法和标定法。直接法是准确称量一定的物质,制成一定体积的溶液;标定法则是先粗略配制一定浓度的溶液,再用已知浓度的溶液标定其浓度。对于在空气中稳定,且试剂纯度高,组成和化学式相符的物质,通常采用直接法;而对于不易提纯、组成不定或容易分解的物质,则采用标定法。
(一)用无水碳酸钠固体配制250mL 0.1000mol/L碳酸钠溶液。
(1)计算需要碳酸钠固体的质量为ag,a=__________。
(2)用分析天平准备称量质量为ag的无水碳酸钠固体,为配制所需的碳酸钠溶液还需要的玻璃仪器有:________________________________________。
(二)用浓盐酸配制250mL约0.2mol/L盐酸并标定其精确浓度。
(3)计算需要浓盐酸(质量分数为36.5%,密度为1.2g/cm3)的体积为bmL,则b=__________(计算结果保留到小数点后一位)。
(4)用量筒量取bmL浓盐酸,缓慢加入盛有(250-b)mL水的烧杯中,用玻璃棒搅拌,即得所需溶液。
(5)用酸式滴定管(注:酸式滴定管是一种可较为精确量取液体体积的量器)量取25.00mL所配盐酸溶液,放入锥形瓶,逐滴加入上述碳酸钠溶液至正好完全反应生成NaCl溶液,消耗碳酸钠溶液的体积为25.00mL,则所配制盐酸的浓度为__________。
(6)为何不用直接法配制盐酸溶液?答:________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知碳碳单键可以绕键轴自由旋转,结构简式为: ![]() 的烃,下列说法正确的是( )
的烃,下列说法正确的是( )
A.分子中至少有9个碳原子处于同一平面上
B.分子中至少有11个碳原子处于同一平面上
C.分子中至少有16个碳原子处于同一平面上
D.该烃属于苯的同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如下图所示的实验装置(支撑用的铁架台省略),按要求回答问题。
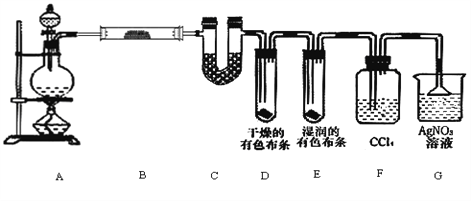
(1)若含有0.2 mol HCl的浓盐酸与足量的MnO2反应制Cl2 ,制得的Cl2体积(标准状况下)总是小于1.12 L的原因是_______________________________________________。
(2)①装置B中盛放的试剂名称为__________,作用是________________________。装置C中盛放的试剂名称为_________________。
②装置D和E中出现的不同现象说明的问题是_________________________________。
③装置F的作用是_________________________。
④写出装置G中发生反应的离子方程式_____________________________________。
(3)为充分证明有氯化氢挥发出来,还应在装置F和G之间连接一个装有_________的广口瓶。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定质量的镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如右图。下列关于反应的说法错误的是
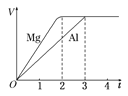
A.镁和铝的物质的量之比为3∶2
B.镁和铝转移电子数之比为1∶1
C.镁和铝的摩尔质量之比为8∶9
D.镁和铝反应所用时间之比为3∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列生活中常见物质的俗名与化学式相对应的是( )
A.生石灰﹣Ca(OH)2
B.小苏打﹣KHCO3
C.重晶石﹣CaSO4
D.醋酸﹣C2H4O2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com