
| A. | 氯气 | B. | 氯化镁 | C. | 溴化钠 | D. | 水 |
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:解答题
 已知制备甲醇的有关化学反应及平衡常数如表所示:
已知制备甲醇的有关化学反应及平衡常数如表所示:| 化学反应 | 反应热 | 平衡常数(850℃) |
| ①CO2 (g)+3H2 (g)═CH3OH(g)+H2O(g) | △H1=-48.8 kJ•molˉ1 | K1=320 |
| ②CO(g)+H2O(g)═H2(g)+CO2(g) | △H2=-41.2 kJ•molˉ1 | K2 |
| ③CO(g)+2H2(g)═CH3OH(g) | △H3 | K3=160 |
| 物质 | H2 | CO2 | CH3OH | H2O |
| 浓度(mol•Lˉ1) | 0.2 | 0.2 | 0.4 | 0.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应速率:乙>甲 | |
| B. | 平衡混合物中SO2的体积分数:乙>甲 | |
| C. | SO2的转化率:乙>甲 | |
| D. | 平衡时O2的体积分数:甲>乙 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
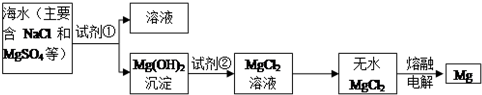
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
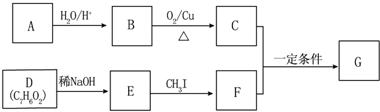
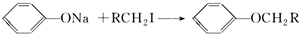
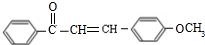 (不要求立体异构).
(不要求立体异构).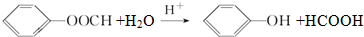 .
.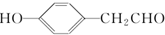 (写结构简式).
(写结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠在空气中燃烧,产物是Na2O | B. | 钠是银白色金属,硬度大,熔点高 | ||
| C. | 钠在空气中燃烧,发出黄色火焰 | D. | 钠与水反应生成O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10% | B. | 9.1% | C. | 1% | D. | 20% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.6 mol | B. | 小于0.6 mol | ||
| C. | 大于0.6 mol | D. | 大于0.3 mol,小于0.6 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
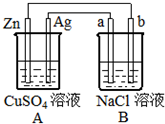 如图所示的装置中电极a、b均为碳棒,两烧杯中所盛溶液均为500mL 1.0mol/L.
如图所示的装置中电极a、b均为碳棒,两烧杯中所盛溶液均为500mL 1.0mol/L.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com