
分析 碳酸氢钠加热分解生成碳酸钠、二氧化碳气体和水,书写化学方程式,根据差量进行计算,由此分析解答.
解答 解:碳酸氢钠加热发生的反应方程式为:2NaHO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,
根据差量法:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O△m
106 62
m(Na2CO3) (m1-m2)g
碳酸钠的质量为:m(Na2CO3)=$\frac{106({m}_{1}-{m}_{2})}{62}$g,故答案为:2NaHO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O;$\frac{106({m}_{1}-{m}_{2})}{62}$.
点评 本题考查了NaHCO3性质实验方案的设计,题目难度中等,正确理解题干信息为解答关键,注意差量法的应用.


 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:解答题
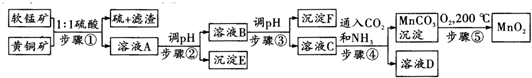
| 沉淀物 | Cu(OH)2 | Fe(OH)3 | Mn(OH)2 | Fe(OH)2 |
| 开始沉淀pH | 4.2 | 1.5 | 7.3 | 6.4 |
| 完全沉淀pH | 6.7 | 3.2 | 9.8 | 9.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | l mol H20最多可形成氢键数目为2NA | |
| B. | 标准状况下,11.2 L甲醛所含的σ键数目为2NA | |
| C. | 常温下,46 g N02所含分子数目为NA | |
| D. | pH=l的硫酸中所含S042-的数目为0.05NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 肯定含有SO2和NO | B. | 肯定含有NO和O2 | ||
| C. | 可能有Cl2 | D. | 肯定没有Cl2、NO2,可能有O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
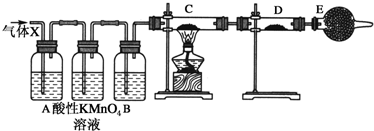
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4Fe2++2I-+3Cl2═4Fe3++I2+6Cl- | |
| B. | 2I-+Cl2═2Cl-+I2 | |
| C. | 2Fe2++2I-+2Cl2═2Fe3++I2+4Cl- | |
| D. | 2Fe2++2I-+2Br-+3Cl2═2Fe3++I2+Br2+6Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳原子易失去最外层的电子形成离子 | |
| B. | 碳原子最外层电子易于其他原子的外层电子形成共同电子对 | |
| C. | 组成有机物的碳原子可以形成单键、双键和三键等多种成键形式 | |
| D. | 组成有机物的氧原子、氮原子、卤素原子分别形成2个、3个、1个共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 氟原子的结构示意图: | B. | 塑料王聚四氟乙烯的结构简式: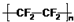 | ||
| C. | 中子数为10的氟原子:${\;}_{9}^{19}$F | D. | 萤石主要成分CaF2电子式: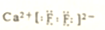 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com