
(15分)硫代硫酸钠(Na2S2O3)俗称保险粉,可用于照相业作定影剂,也可用于纸浆漂白作脱氯剂等。实验室可通过Na2S、Na2CO3和SO2共同反应来制取Na2S2O3。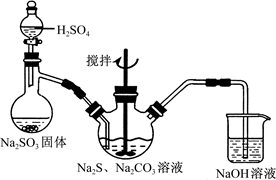
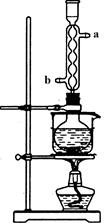
图1 图2
(1)写出图1所示装置中三颈瓶中由反应制取Na2S2O3的化学方程式_ ___。
如将分液漏斗中的H2SO4改成浓盐酸,则三颈烧瓶内除Na2S2O3生成外,还有_____(填化学式)杂质生成。
(2)为测定所得保险粉样品中Na2S2O3·5H2O的质量分数,可用标准碘溶液进行滴定,反应方程式为2Na2S2O3+I2===2NaI+Na2S4O6。
① 利用KIO3、KI和HCl可配制标准碘溶液。写出配制时所发生反应的离子方程式:___________________。
② 准确称取一定质量的Na2S2O3·5H2O样品于锥形瓶中,加水溶解,并滴加__ 作指示剂,用所配制的标准碘溶液滴定。滴定时所用的玻璃仪器除锥形瓶外,还有_____。
③ 若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则会使样品中Na2S2O3·5H2O的质量分数的测量结果______(填“偏高”“偏低”或“不变”)。
(3)本实验对Na2S的纯度要求较高,利用图2所示的装置可将工业级的Na2S提纯。已知Na2S常温下微溶于酒精,加热时溶解度迅速增大,杂质不溶于酒精。提纯步骤依次为:
① 将已称量好的工业Na2S放入圆底烧瓶中,并加入一定质量的酒精和少量水;
② 按图2所示装配所需仪器,向冷凝管中通入冷却水,进 出(用字母“a”、“b”填空)水浴加热;
③ 待_____时,停止加热,将烧瓶取下;
④ ___________________________;
⑤ ________________________;
⑥ 将所得固体洗涤、干燥,得到Na2S·9H2O晶体。
(15分)
(1) 2Na2S+Na2CO3+4SO2===3Na2S2O3+CO2 (2分) NaCl(1分)
(2) ① IO +5I-+6H+===3I2+3H2O(2分)
+5I-+6H+===3I2+3H2O(2分)
② 淀粉溶液 酸式滴定管(2分) ③偏低 (1分)
(3) ② b a (1分)
③ 烧瓶中固体不再减少(2分) ④ 趁热过滤(2分)
⑤ 将所得滤液冷却结晶,过滤(2分)
解析试题分析:(1)Na2S、Na2CO3和SO2共同反应来制取Na2S2O3,根据元素守恒,同时生成CO2,所以化学方程式为:)2Na2S+Na2CO3+4SO2===3Na2S2O3+CO2;如果将分液漏斗中的H2SO4改成浓盐酸,溶液含有Cl?,则三颈烧瓶内除Na2S2O3生成外,还有NaCl。
(2)①KIO3、KI和HCl可配制标准碘溶液,利用KIO3、KI在酸溶液中发生的氧化还原反应生成单质碘,反应的离子方程式为:IO3-+5I-+6H+=3I2+3H2O
②用配制的碘溶液滴定硫代硫酸钠,利用碘单质遇碘单质变蓝指示反应终点;碘溶液具有氧化性,应选用酸式滴定管。
③滴定时振荡不充分,刚看到溶液局部变色就停止滴定,消耗标准溶液体积减小,则会使样品中Na2S2O3?5H2O的质量分数的测量偏低
(3)②为了充分冷却,应使冷水充满冷凝管,则应向冷凝管的b处通入水,a处出水。
③依据Na2S常温下微溶于酒精,加热时溶解度迅速增大,杂质不溶于酒精,根据提纯硫化钠晶体的实验步骤和方法可知,但烧瓶中固体不再减少,说明硫化钠全部溶解于酒精中,不溶的杂质沉淀过滤除去。
④温度增大硫化钠在酒精中溶解度增大,热溶液过滤得到滤液中主要是硫化钠的酒精溶液,实验操作为趁热过滤。
⑤热的滤液通过冷却、结晶、过滤得到晶体。
考点:本题考查实验方案的设计与评价、基本仪器和基本操作、方程式的书写。


 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:单选题
下列能大量共存且溶液为无色透明的离子组是
| A.Al3+、Na+、HCO3-、Cl- | B.Fe3+、NO3-、Cl-、SO42- |
| C.Na+、H+、SO32-、NO3- | D.SiO32-、Na+ 、K+、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某无色溶液中含有:①Na+ ②Ba2+ ③Cl- ④Br- ⑤SO⑥SO中的一种或几种,依次进行下列实验,且每步所加试剂均过量,观察到的现象如下表,下列结论正确的是
| 步骤 | 操作 | 现象 |
| (1) | 用pH试纸检验 | 溶液的pH大于7 |
| (2) | 向溶液中滴加氯水,再加入CCl4振荡,静置 | CCl4层呈橙色 |
| (3) | 向(2)所得的溶液中加入Ba(NO3)2溶液和稀HNO3 | 有白色沉淀产生 |
| (4) | 将(3)中的溶液过滤,向滤液中加入AgNO3溶液和稀HNO3 | 有白色沉淀产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(11分)含有下列离子的五种溶液①Ag+②Mg2+③Fe2+④Al3+⑤Fe3+试回答下列问题:
(1)既能被氧化又能被还原的离子是____________(填离子符号,下同)
(2)向③中加入NaOH溶液,现象是 有关反应的离子方程式或化学方程式为 。
(3)加入过量NaOH溶液无沉淀的是_____________
(4)加铁粉溶液质量增重的是_________,溶液质量减轻的___________
(5)遇KSCN溶液呈红色的是_________________________
(6)能用来鉴别Cl–存在的离子是___________
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下列叙述I和II均正确并有因果关系的是
| 选项 | 叙述I | 叙述II |
| A | KNO3的溶解度大 | 用重结晶法除去KNO3中混有的NaCl |
| B | BaSO4难溶于酸 | 用盐酸和BaCl2溶液检验SO42- |
| C | NH3能使酚酞溶液变红 | NH3可用于设计喷泉实验 |
| D | Ca(OH)2能制成澄清石灰水 | 可配制2.0 mol?L-1的Ca(OH)2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(15分)实验探究是学习化学的一个重要方法,某实验小组的同学利用下列装置完成一些常见气体制备以及相关物质性质探究(夹持装置及连接橡胶管已省略,其中装置E有多个供使用)。
可供选择的液体试剂及固体药品:
| 液体试剂 | 固体药品 |
| 稀硫酸、稀盐酸、稀硝酸、NaOH溶液、浓氨水、5%H2O2溶液、浓盐酸、饱和食盐水 | CaCO3、CaO、MnO2、KMnO4、CaC2、 碱石灰、Cu、Zn、Na2S |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
废旧锂离子池的正极材料(主要含有LiCoO2及少量的Al、Fe等)可用于回收钴、锂,工艺流程如下:
(1)在上述溶解过程中,S2O32-被氧化成SO42-,LiCoO2在溶解过程中发生反应的化学方程式为 ,还原产物是 。
(2)在上述除杂过程中,通入空气的作用是 废渣的主要成分是 。
(3)“沉淀钴”和“沉淀锂”的离子方程式分别为 。
(4)除了废渣可以回收利用外,本工艺还可回收的副产品是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
电镀厂镀铜废水中含有CN-和Cr2O72-离子,需要处理达标后才能排放。该厂拟定下列流程进行废水处理, 回答下列问题:
(1)上述处理废水流程中主要使用的方法是 。
(2)②中反应后无气体放出,该反应的离子方程式为 。
(3)步骤③中,每处理0.4mol Cr2O72-时转移电子2.4mol,该反应离子方程式为 。
(4)取少量待测水样于试管中,加入NaOH溶液,观察到有蓝色沉淀生成,再加Na2S溶液, 蓝色沉淀转化成黑色沉淀,请使用化学用语和文字解释产生该现象的原因 。
(5)目前处理酸性Cr2O72-废水多采用铁氧磁体法。该法是向废水中加入FeSO4·7H2O将Cr2O72-还原成Cr3+,调节pH,Fe、Cr转化成相当于 (铁氧磁体,罗马数字表示元素价态)的沉淀。处理1mol Cr2O72-,需加入a mol FeSO4?7H2O,下列结论正确的是 。
(铁氧磁体,罗马数字表示元素价态)的沉淀。处理1mol Cr2O72-,需加入a mol FeSO4?7H2O,下列结论正确的是 。
| A.x ="0.5" ,a =8 | B.x ="0.5" ,a = 10 | C.x =" 1.5" ,a =8 | D.x =" 1.5" ,a = 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
铁、铝、铜等金属及其化合物在日常生活中应用广泛,请根据下列实验回答问题:
(1)生产中含有一种铁碳化合物X(Fe3C)。X在足量的空气中高温煅烧,生成有磁性的固体Y,将Y溶于过量盐酸后,溶液中含有的大量阳离子是________。
(2)氧化铁是重要的工业颜料,用废铁屑制备它的流程如下所示。
回答下列问题:
①操作Ⅰ所用的分离仪器的名称是________;操作Ⅱ的名称是________,该操作的具体方法是________。
②Na2CO3溶液可以除油污,原因是(用离子方程式表示)________。
③请写出生成FeCO3沉淀的离子方程式:________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com