
| A.该元素基态原子中共有3个电子 | B.该元素原子核外有5个能层 |
| C.该元素原子最外层共有3个电子 | D.该元素原子M能层共有8个电子 |
科目:高中化学 来源:不详 题型:单选题
| A.X、M两种元素形成的化合物的晶体中一定含有离子键,不可能含有共价键 |
| B.由于W、Z、M元素的氢气化物相对分子质量依次减小,所以其沸点依次降低 |
| C.元素Y、Z、W的单质晶体的熔点高低顺序为:Y>Z>W |
| D.化合物ZW2的分子空间构型为直线形 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
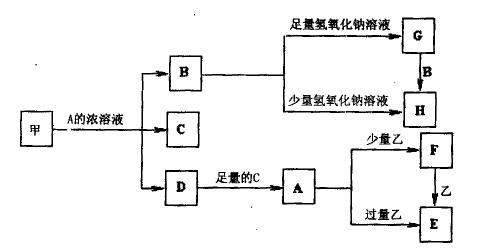
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
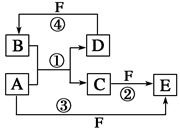
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.各能级的原子轨道数按s、p、d、f的顺序依次为1、3、5、7 |
| B.各能层的能级都是从s能级开始至f能级结束 |
| C.各能层含有的能级数为n-1 |
| D.各能层含有的电子数为2n2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.126C表示碳原子的质量数是18 |
| B.23592U表示铀原子的质量数是235,核外有235个电子 |
| C.2311Na表示钠原子的质量数为11,核内有23个中子 |
| D.21H表示氢原子由1个质子,1个中子和1个电子组成。 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题



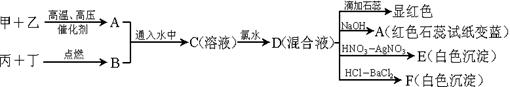
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 元素代号 | I1 | I2 | I3 | I4 |
| E | 500 | 4600 | 6900 | 9500 |
| F | 740 | 1500 | 7700 | 10500 |
| H | 580 | 1800 | 2700 | 11600 |
| I | 420 | 3100 | 4400 | 5900 |
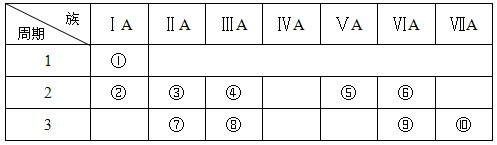
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 是其电子层数的2倍,Z在同周期的主族元素中原子半径最大,W是地壳中含量最多的金属元素,L的单质晶体熔点高、硬度大,是一种重要的半导体材料。用化学用语回答下列问题:
是其电子层数的2倍,Z在同周期的主族元素中原子半径最大,W是地壳中含量最多的金属元素,L的单质晶体熔点高、硬度大,是一种重要的半导体材料。用化学用语回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com