

| Cl2的体积 (标准状况下)/L | 2.8 | 5.6 | 11.2 |
| n(A-)/mol | 1.25 | 1.5 | 2 |
| n(B-)/mol | 1.5 | 1.4 | 0.9 |
| n(C-)/mol | a | 0 | 0 |
分析 某固体混合物含NH4I、NaHCO3、AlCl3、MgBr2、FeCl2中的几种加入过量氢氧化钠浓溶液加热反应生成气体为氨气,固体中含NH4I,生成白色沉淀久置无变化判断沉淀为Mg(OH)2,固体中有MgBr2、无FeCl2 ,无色溶液加入适量稀盐酸生成白色沉淀,加入过量稀盐酸沉淀溶解,判断为Al(OH)3,无气体生成则固体中无NaHCO3,
(1)分析可知铵盐和氢氧化钠反应生成气体氨气;
(2)上述分析判断固体成分NH4I、MgBr2、AlCl3 ;
(3)碘离子与溴离子的还原性强弱顺序为:I->Br-,加入氯气2.8L时溶液中I-amol,则说明通入2.8LCl2只发生:Cl2+2I-═I2+2Cl-,2.8L变成5.6L,消耗2.8L Cl2的物质的量为$\frac{2.8L}{22.4L/mol}$=0.125mol,先后发生:Cl2+2I-═I2+2Cl-,Cl2 +2Br-═Br2+2Cl-,根据反应方程式计算;
(4)通过以上分析知,当通入Cl2的体积为3.36L即0.15mol(标准状态下)时,溶液中发生反应的离子方程式为Cl2+2I-=2Cl-+I2;
n(Cl-)=1.25mol-0.125mol×2=1mol、n(Br-)=1.5mol、n(I-)=0.4mol,据此计算原固体混合物中各组成成分的物质的量之比.
解答 解:(1)某固体混合物含NH4I、NaHCO3、AlCl3、MgBr2、FeCl2中的几种加入过量氢氧化钠浓溶液加热反应生成气体为氨气,
故答案为:NH3 ;
(2)某固体混合物含NH4I、NaHCO3、AlCl3、MgBr2、FeCl2中的几种加入过量氢氧化钠浓溶液加热反应生成气体为氨气,固体中含NH4I,生成白色沉淀久置无变化判断沉淀为Mg(OH)2,固体中有MgBr2、无FeCl2 ,无色溶液加入适量稀盐酸生成白色沉淀,加入过量稀盐酸沉淀溶解,判断为Al(OH)3,无气体生成则固体中无NaHCO3,该固体混合物的成分为NH4I、MgBr2、AlCl3 ,
故答案为:NH4I、MgBr2、AlCl3 ;
(3)溶液中阴离子还原性强弱顺序为:I->Br->Cl-,2.8L氯气的物质的量为$\frac{2.8L}{22.4L/mol}$=0.125mol,通入0.125mol氯气时溶液中有I-,所以Br-没有参加反应,所以溶液中n(Br-)=1.5mol,n(B-)为溴离子,溶液中氯离子为通入氯气生成的和原来溶液中存在的,判断A-离子为Cl-,C-离子为I-离子,Cl原子守恒得原来n(Cl-)=1.25mol-0.125mol×2=1mol;通入5,6L氯气物质的量=$\frac{5.6L}{22.4L/mol}$=0.25mol氯气时溶液中没有I-,则碘离子完全反应,且n(Br-)=1.4mol,说明有0.1mol溴离子参加反应,则碘离子完全反应,根据转移电子相等得n(I-)=0.25mol×2-0.1mol×1=0.4mol,根据反应:Cl2+2I-═I2+2Cl-,该反应中生成0.25mol氯离子消耗碘离子,所以a=0.5mol-0.25mol=0.15mol,
故答案为:0.15;
(4)通过以上分析知,当通入Cl2的体积为3.36L即0.15mol(标准状态下)时,溶液中发生反应的离子方程式为Cl2+2I-=2Cl-+I2;
n(Cl-)=1.25mol-0.125mol×2=1mol、n(Br-)=1.5mol、n(I-)=0.4mol,
n(AlCl3):n(MgBr2):n(NH4I)=$\frac{1}{3}$×1:$\frac{1.5}{2}$:0.4=20:45:24,
答:原固体混合物中各组成成分的物质的量之比为20:45:24.
点评 本题考查了物质组成成分的定量关系、物质性质和物质发生氧化还原反应的定量计算分析判断,掌握基础是解题关键,题目难度较大.


科目:高中化学 来源: 题型:解答题
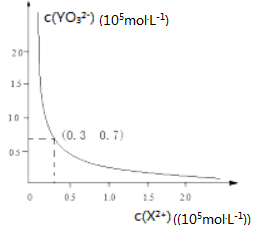
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. .
. =O$→_{H+}^{ROH}$
=O$→_{H+}^{ROH}$
 ,需要经历的反应类型有①②③④(填写编号).①加成反应 ②消去反应 ③取代反应 ④氧化反应 ⑤还原反应.写出制备化合物
,需要经历的反应类型有①②③④(填写编号).①加成反应 ②消去反应 ③取代反应 ④氧化反应 ⑤还原反应.写出制备化合物  的最后一步反应的化学方程式
的最后一步反应的化学方程式 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
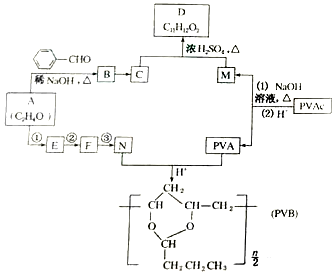
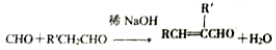 (R、R′表示烃基或氢)
(R、R′表示烃基或氢)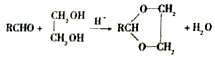
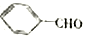 合成B的化学方程式是
合成B的化学方程式是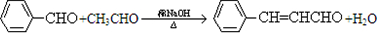 .
.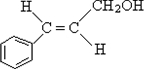 .
.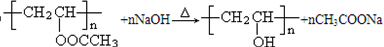 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 700℃ | 900℃ | |
| K1 | 1.47 | 2.15 |
| K2 | 2.38 | 1.67 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com