
| A. | 中国古代利用明矾溶液的酸性清除铜镜表面的铜锈 | |
| B. | 因患“禽流感”而被捕杀的家禽尸体常用生石灰处理 | |
| C. | 《本草经集注》中记载了区分硝石(KNO3)和朴消(Na2SO4)的方法:“以火烧之,紫青烟起,乃真硝石也”;这是利用了“焰色反应” | |
| D. | 煤经过气化和液化等物理变化可以转化为清洁燃料 |
分析 A.明矾溶液中Al3+水解使溶液呈酸性,铜锈为Cu2(OH)2CO3,溶于酸性溶液;
B.A.生石灰与水反应放热,生成的氢氧化钙;
C.钾元素的焰色反应为紫色;
D.煤的气化和液化属于化学变化.
解答 解:A.明矾溶液中Al3+水解使溶液呈酸性,铜锈为Cu2(OH)2CO3,溶于酸性溶液,故利用明矾溶液的酸性清除铜镜表面的铜锈,故A正确;
B.生石灰与水反应放热,生成的氢氧化钙呈碱性,加热、强碱都能使蛋白质变性,能杀菌消毒,故B正确;
C.钾元素的焰色反应为紫色,灼烧硝酸钾,火焰为紫色,灼烧硫酸钠,火焰为黄色,所以区分二者利用了“焰色反应”,故C正确;
D.煤的气化为碳和水反应生成水煤气的过程,液化为为碳和水反应生成甲醇的过程,都化学变化,故D错误.
故选D.
点评 本题考查了化学在社会、生产、生活中的应用,利用化学知识解答生活问题,熟悉物质的性质是解题关键,侧重于基础知识的考查,有利于培养学生的良好的科学素养和提高学习的积极性,难度不大.


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 明矾易水解生成胶体,可用作净水剂 | |
| B. | 晶体硅熔点高硬度大,可用作芯片 | |
| C. | 氮气化学性质稳定,可用作粮食保护气 | |
| D. | NaClO具有强氧化性,可作织物漂白剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
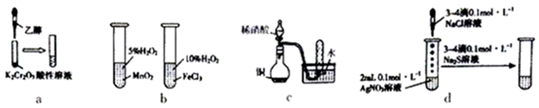
| A. | a图,滴加乙醇,试管中橙色溶液变为绿色,乙醇发生取代反应生成乙酸 | |
| B. | b图,左边试管中产生气泡迅速,说明二氧化锰的催化效果比氯化铁好 | |
| C. | c图,根据试管中收集到无色气体,能验证铜与稀硝酸的反应产物是NO | |
| D. | d图,试管中先有白色沉淀,后有黑色沉淀生成,能确定Ksp(AgCl)>Ksp(Ag2S) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1 CH3COONa溶液与0.1 mol•L-1 CaCl2溶液等体积混合:c(Na+)+c(Ca2+)═c(CH3COO-)+c(CH3COOH)+c(Cl-) | |
| B. | 少量Cl2通入过量泠的0.1 mol•L-1 NaOH溶液中:c(Na+)═c(HClO)+c(ClO-)+c(Cl-) | |
| C. | 0.1 mol•L-1CH3COONa溶液与0.1 mol•L-1 HCl溶液混合至pH=7:c(Na+)>c(Cl-)═c(CH3COOH) | |
| D. | 0.2 mol•L-1 NH3•H2O溶液与0.1 mol•L-1 HCl溶液等体积混合:c(Cl-)+c(H+)═c(NH3•H2O)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸的分子模型可表示为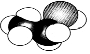 | |
| B. | 糖类、油脂、蛋自质都是高分子化合物 | |
| C. | 乙烯使溴的四氯化碳溶液褪色是因为发生了加成反应 | |
| D. | 炒菜时加酒和醋能使菜味香可口,原因是有酯类物质生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1LpH=1的硫酸溶液中含有的H+数为0.2NA | |
| B. | 12g石墨和C60的混合物中质子总数为6NA | |
| C. | lmolNa2O2和足量的水完全反应,转移电子数为2NA | |
| D. | 2mol热的浓硫酸与足量Cu充分反应生成的SO2在标准状况下的体积约为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 实验事实 | 理论解释 |
| A | Be原子的第一电离能小于B原子 | 同周期元素原子的电离能随原子序数增大而增大 |
| B | CH4为正四面体形分子 | CH4分子中C为sp3杂化,键角为109°28′ |
| C | 金刚石的熔点高于石墨 | 金刚石是原子晶体,石墨是分子晶体 |
| D | HF的沸点高于HCl | HF分子间能形成氢键,HCl不能 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com