
| A. | 0.1mol | B. | 0.2mol | C. | 0.05mol | D. | 0.025mol |
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 由图甲知,A点SO2的平衡浓度为0.4 mol/L | |
| B. | 由图甲知,B点SO2、O2、SO3的平衡浓度之比为2:1:2 | |
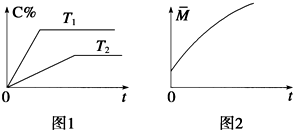
| C. | 压强为0.50 MPa时不同温度下SO2转化率与温度关系如图乙,则T2>T1 | |
| D. | 达平衡后,缩小容器容积,则反应速率变化图象可以用图丙表示 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在密闭容器中投入一定量的A和B发生反应:
在密闭容器中投入一定量的A和B发生反应:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.02mol/L醋酸溶液与等体积的水混合 | |
| B. | 0.02mol/L醋酸与0.02mol/LNaOH溶液等体积混合液 | |
| C. | 0.03mol/L醋酸与0.01mol/LNaOH溶液等体积混合液 | |
| D. | pH=2的盐酸与pH=12的NaOH溶液等体积混合液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe(SCN)3溶液中加入固体KSCN后颜色变深 | |
| B. | 棕红色NO2加压后颜色先变深后变浅 | |
| C. | 打开碳酸型饮料的瓶盖,有大量的气体从饮料中冒出 | |
| D. | 用高压锅蒸煮食物更省时间 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应容器内的压强不随时间改变 | |
| B. | 反应容器内P、Q、R、S四者共存 | |
| C. | P的生成速率和S的生成速率相等 | |
| D. | 反应容器内的气体总物质的量不随时间变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com