
下列物质中既能跟稀H2SO4反应,又能跟氢氧化钠溶液反应的是
①NaHCO3 ②Al2O3 ③Al(OH)3 ④Al ⑤ NaAlO2
A.③④ B.②③④ C.①②③④ D.全部
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2015-2016学年黑龙江省高一上期末化学试卷(解析版) 题型:计算题
回答以下问题:
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是 。
(2)另称取已去除表面氧化物的铁钉(碳素钢)6.0g放入15.0ml浓硫酸中,加热,充分应后得到溶液X并收集到气体Y。
①甲同学认为X中除Fe3+外还可能含有Fe2+。写出生成Fe2+所有可能的离子方程式: 。
②乙同学取336ml(标准状况)气体Y通入足量氯水中,发生反应的化学方程式为: 。
然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33g。由于此推知气体Y中SO2的体积分数为 。
(3)向100ml水中投入Na和Al共16克,充分反应后剩余金属1g。计算放出H2的体积为 升(标准状况下)
(4)向含有0.3mol NaAlO2的溶液中滴加1mol/L HCl,当生成7.8克沉淀时,加入盐酸的体积为 mL
(5)向一定量的Fe、Fe2O3和CuO混合物投入120 ml 2.2 mol/L的硫酸溶液中,充分反应后生成896 mL标准状况下的气体,得不溶物1.28 g,过滤后,向滤液中加入2 mol/L的NaOH溶液,加至40 mL时开始出现沉淀,则滤液中FeSO4的物质的量浓度为(设滤液体积为120 ml) mol/L
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西省高二12月月考化学试卷(解析版) 题型:推断题
某烃类化合物A的质谱图表明其相对分子质量为84,红外光谱表明分子中含有碳碳双键,核磁共振氢谱表明分子中只有一种类型的氢。
(1)A的结构简式为___________;
(2)A中的碳原子是否都处于同一平面?____________(填“是”或者“不是”);
(3)在图中,D1、D2互为同分异构体,E1、E2互为同分异构体。
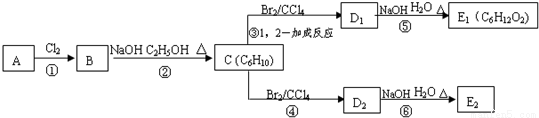
反应②的化学方程式为_____________;
C的系统命名名称是_____________;
E2的结构简式是_____________;
④、⑥的反应类型依次是______________、___________;
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川阆中中学校高二上第二次段考化学试卷(解析版) 题型:选择题
某烯烃与氢气加成后得到2.2-二甲基戊烷,烯烃的名称是
A.2.2-二甲基-3-戊烯 B.2.2-二甲基-4-戊烯
C.4.4-二甲基-2-戊烯 D.2.2-二甲基-2-戊烯
查看答案和解析>>
科目:高中化学 来源:2015-2016学年天津静海一中高一上12月学业调研化学卷(解析版) 题型:填空题
I. 书写下列反应的化学方程式
(1) 用FeCl3溶液作为腐蚀液刻制铜印刷电路板 ;
(2) 工业上粗硅的制取:
II. 与量有关的离子方程式书写
(1) Ba(OH)2溶液与NaHSO4溶液反应后溶液呈中性:
离子方程式 ;
(2) Ca(HCO3)2溶液与少量NaOH溶液反应
离子方程式 ;
(3) Al2(SO4)3溶液与过量NaOH溶液反应
离子方程式 ;
(学法题)书写此类离子方程式的关键是: 。
查看答案和解析>>
科目:高中化学 来源:2016届天津市高三上12月学业调研化学试卷(解析版) 题型:选择题
下列变化不能用勒夏特列原理解释的是
A.红棕色的NO2气体加压后颜色先变深再变浅
B.打开汽水瓶,看到有大量的气泡逸出
C.二氧化硫转化为三氧化硫时增加空气的量以提高二氧化硫的转化率
D.H2、I2、HI混合气体加压后颜色变深
查看答案和解析>>
科目:高中化学 来源:2016届山东省高三上学期12月阶段测化学试卷(解析版) 题型:选择题
某溶液可能含有Cl-、SO、CO、NH、Fe3+、Al3+和K+。取该溶液100 mL,加入过量NaOH溶液,加热,得到0.02 mol气体,同时产生红褐色沉淀;过滤,洗涤,灼烧,得到1.6 g固体;向上述滤液中加足量BaCl2溶液,得到4.66 g不溶于盐酸的沉淀。由此可知原溶液中
A.至少存在5种离子
B.SO、NH一定存在,Cl-可能不存在
C.Cl-一定存在,且c(Cl-)≥0.4 mol·L-1
D.CO、Al3+一定不存在,K+可能存在
查看答案和解析>>
科目:高中化学 来源:2015-2016年江西省高二上12月月考化学试卷(解析版) 题型:实验题
某化学兴趣小组需100mL某物质的量浓度的FeSO4溶液作标准试剂,现有外观颜色发黄的硫酸亚铁晶体、浓硫酸、稀盐酸、KMnO4溶液、溴水、KSCN溶液、石蕊、酚酞及中学化学常用化学仪器,实验过程如下:
Ⅰ.配制FeSO4溶液
(1)下列关于FeSO4溶液配制操作步骤的合理顺序为A→B→__________(填字母).
A.在盛适量水的烧杯中滴加少量浓H2SO4后搅拌均匀并冷却到室温
B.称取一定质量的FeSO4晶体样品
C.将样品溶于已配制的稀H2SO4中,用玻璃棒搅拌至样品充分溶解
D.过滤后,将滤液转移到容量瓶中,加水稀释至指定刻度
E.往硫酸亚铁溶液中加入稍过量的铁粉,充分搅拌,静置一段时间至不再有气体冒出为止
Ⅱ.标定FeSO4溶液的浓度
(1)用滴定管量取20.00mL FeSO4溶液放入锥形瓶中,用0.10mol•L-1的酸性KMnO4溶液滴至终点,耗去KMnO4溶液20.00mL,若生成物中Mn元素全部呈+2价,据此可测得FeSO4溶液的物质的量浓度为______mol•L-1.
(2)滴定时选用________(A.石蕊 B.酚酞 C.不用指示剂,填字母)为指示剂,理由是__________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com