
| A. | 11.2 L氧气中所含有的原子数为NA | |
| B. | 7.8g的Na2O2中含有的阴离子的数目为0.2NA | |
| C. | 0.10mol Fe 粉与足量水蒸气反应生成的H2分子数为0.10NA | |
| D. | 54g Al分别与足量的稀硫酸及氢氧化钠溶液反应失去的电子数都是6NA |
分析 A、没有说明是在标准状况下,故不能计算其物质的量;
B、每个过氧化钠中有一个阴离子;
C、铁和水蒸气反应每3摩尔铁生成4摩尔氢气;
D、54克铝是2mol,无论和酸还是和碱反应都显示+3价,即转移电子数为6NA.
解答 解:A、没有说明是在标准状况下,故不能计算其物质的量,故不选A;
B、每个过氧化钠中有一个阴离子,所以7.8克,即0.1mol的过氧化钠中含有阴离子数为0.1 NA,故不选B;
C、铁和水蒸气反应每3mol铁生成4mol氢气,故0.1mol铁,生成的氢气的分子数不是0.1 NA,故不选C;
D、54克铝是2mol,无论和酸还是和碱反应都显示+3价,即转移电子数为是6NA,故选D.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物中可能含有共价键,共价化合物中可能含有离子键 | |
| B. | 一定条件下1 mol N2与3 mol H2在密闭容器中充分反应可生成2 mol NH3 | |
| C. | 铁质器件附有铜质配件,在接触处易生铁锈 | |
| D. | 非极性共价键只存在于双原子单质分子里 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | ①、②、③与④互为同分异构体 | |
| B. | ①、④互为同系物 | |
| C. | ③的分子式为C12H8O4 | |
| D. | 等物质的量②、④分别在足量氧气中完全燃烧,前者消耗氧气比后者少 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 222 kJ•mol-1 | B. | 444 kJ•mol-1 | C. | 462 kJ•mol-1 | D. | 924 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g).其化学平衡常数K和温度T的关系如下表:
在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g).其化学平衡常数K和温度T的关系如下表:| T℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
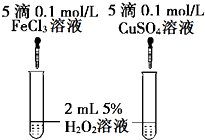 一定温度下,2L的密闭容器中,发生反应:A2(g)+3B2(g)?2AB3(g).A2在5min内物质的量由12mol变成了4mol.
一定温度下,2L的密闭容器中,发生反应:A2(g)+3B2(g)?2AB3(g).A2在5min内物质的量由12mol变成了4mol.| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

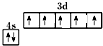 ,与D同周期的所有元素的基态原子中最外层电子数与D原子相同的元素有8种.
,与D同周期的所有元素的基态原子中最外层电子数与D原子相同的元素有8种.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com