
【题目】下列有关氨气的说法不正确的是
A. 液氨可作制冷剂 B. 氨气可用浓硫酸干燥
C. 氨气极易溶于水 D. 氨气的水溶液具有碱性
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
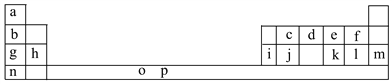
试回答下列问题:
(1)元素p为26号元素,请写出其基态原子电子排布式:___________________。
(2)d与a反应的产物的分子中中心原子的杂化形式为__________,该分子是__________(填“极性”或“非极性”)分子。
(3)h的单质在空气中燃烧发出耀眼的白光,请用原子结构的知识解释发光的原因:__________________________________________________________。
(4)o、p两元素的部分电离能数据列于下表:
元素 | o | p | |
电离能/kJ·mol-1 | I1 | 717 | 759 |
I2 | 1 509 | 1 561 | |
I3 | 3 248 | 2 957 | |
比较两元素的I2、I3可知,气态o2+再失去一个电子比气态p2+再失去一个电子难。对此,你的解释是__________________________________________________;
(5)i单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。
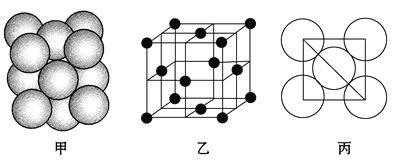
请回答:
①晶胞中i原子的配位数为________,一个晶胞中i原子的数目为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方法能达到目的是
A. 用焰色反应鉴別Na2CO3溶液和NaCl溶液
B. 用分液漏斗分离食醋中的乙酸与水
C. 用结晶的方法分离氯化钠和硝酸钾的混合物
D. 用NaOH溶液除去Cl2中混有的少量HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机花儿会务X(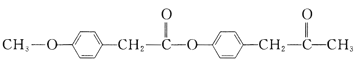 )是有机精细化工的重要中间体,实验室中以M(
)是有机精细化工的重要中间体,实验室中以M(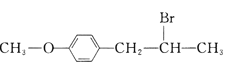 )为原料合成X的路线如下:
)为原料合成X的路线如下:
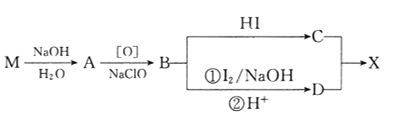

回答下列问题:
(1)B的核磁共振氢谱上有________组峰。
(2)D分子中含有的官能团有_________________________。(填名称)
(3)下列常见含钠试剂能与C反应的有______________。(填标号)
a.氯化钠 b.氢氧化钠 c.纯碱 d.碳酸氢钠
(4)由B转化为C的化学方程式为______________________________,该反应的反应类型是_______________________。
(5)E是D的同分异构体,在苯环的对位上各有一个取代基,能够发生银镜反应和水解反应,1molE与足量钠反应可生成0.5molH2,则E可能的结构有_____种。
(6)有机物F(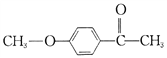 )也是一种重要的有机精细化工中间体,写出由
)也是一种重要的有机精细化工中间体,写出由 ![]() 制备F的合成路线。(其他试剂任选;已知马氏规则:在不对称烯烃的加成反应中,氢原子总是加在含氢较多的碳原子上。如:
制备F的合成路线。(其他试剂任选;已知马氏规则:在不对称烯烃的加成反应中,氢原子总是加在含氢较多的碳原子上。如:![]() )_________________.
)_________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1949年度诺贝尔化学奖授予为研究臭氧做出贡献的化学家。臭氧能吸收有害紫外线,保护人类赖以生存的空间。O3分子的结构如图:呈V形,键角116.5°。三个原子以一个O原子为中心,与另外两个O原子分别构成一个非极性共价键;中间O原子提供2个电子,旁边两个O原子提供1个电子,构成一个特殊的化学键(虚线内部分)——三个O原子均等的享有着4个电子。请回答:
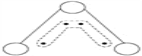
(1)题中非极性共价键是__键,特殊的化学键是 键。
(2)臭氧与氧气是_____。
(3)下列物质的分子与O3分子的结构最相似的是_______。
A.H2O B.CO2 C.SO2 D.BeCl2
(4)子中某一原子有1对没有跟其他原子共用的电子叫孤电子对,那么 O3分子有___对孤电子对。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)有以下几种物质:①碳酸氢钠晶体 ②液态氯化氢 ③铁 ④蔗糖 ⑤酒精 ⑥熔融的K2SO4 ⑦干冰 ⑧石墨。试回答(填序号):
(1)以上物质能导电的是_________________________。
(2)以上物质中属于非电解质的是_________________________。
(3)以上物质中溶于水后水溶液能导电的是_________________________。
(4)①、②在水溶液中反应的离子方程式为_________________________________。
(二)某溶液的溶质可能由下列离子组成:Cl-、![]() 、
、![]() 、H+、Ba2+、Na+,某同学进行了如下实验:
、H+、Ba2+、Na+,某同学进行了如下实验:
Ⅰ 向溶液中加入过量的BaCl2溶液,有白色沉淀产生,过滤;
Ⅱ 向Ⅰ中滤液中加入AgNO3溶液,有白色沉淀产生;
Ⅲ 将Ⅰ中的沉淀加入稀盐酸中,沉淀部分消失,有气体产生。
(5)依据以上实验可以推断,原溶液中一定含有____________ (用离子符号表示,下同);一定没有______________;可能含有________________,检验是否存在该离子的方法为_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在探索苯结构的过程中,人们写出了符合分子式“C6H6”的多种可能结构(如图),下列说法正确的是( )

A. 1--5对应的结构中所有原子均可能处于同一平面的有1个
B. 1--5对应的结构均能使溴的四氯化碳溶液褪色
C. 1--5对应的结构中的一氯取代物只有1种的有3个
D. 1--5对应的结构均不能使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼(Mo)是一种重要的过渡金属元素,钼酸钠(Na2MoO4)是一种无公害型冷却水系统的金属缓蚀剂。以钼精矿(主要成分为MoS2)为原料制备金属钼和钼酸钠晶体的主要流程如图所示。
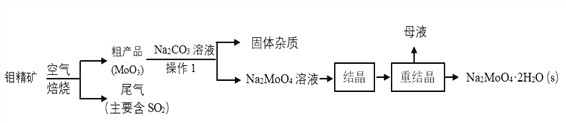
(1)Na2MoO4·2H2O 中钼元素的化合价为____________;
(2)在焙烧反应中,每生成1mol MoO3时转移电子数为:_______ (以NA表示阿伏加德罗常数的值);
(3)操作1中,粗产品中的MoO3与Na2CO3溶液充分反应后,生成Na2MoO4和另外一种物质,该物质的电子式为_____;
(4)重结晶得到的母液可以在下次重结晶时重复使用,但达到一定次数后必须净化处理,原因______________________________________;
(5)结晶操作前需加入Ba(OH)2固体以除去溶液中的SO42-,SO42-的最大去除率是_____(结果保留一位小数)[已知:碱浸液中c(MoO42-)=0.80mol·L-1,(SO42-)=0.04mol·L-1,Ksp(BaSO4)=1.0×10-10,Ksp(BaMoO4)=4.0×10-8,Ba(OH)2引起的溶液体积变化忽略。]
(6)下图是碳钢在3 种不同介质中的腐蚀速率实验结果:
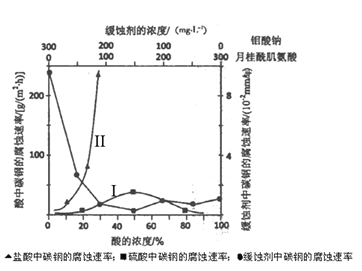
①试分析I、II曲线变化趋势不同的原因________________________________________
②空气中钼酸盐对碳钢的缓蚀原理是在钢铁表面形成FeMoO4-Fe2O3 保护膜。密闭式循环冷却水系统中的碳钢管道缓蚀,除需加入钼酸盐外还需加入NaNO2。则NaNO2的作用是_________________________________________________。
③要使碳素钢的缓蚀效果最优,钼酸钠和月桂酰肌氨酸的浓度比应为_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com