
下列物质的使用不涉及化学变化的是
A.明矾用作净水剂 B.液氨用作制冷剂 C.氢氟酸刻蚀玻璃 D.生石灰作干燥剂
科目:高中化学 来源:2015届辽宁省高三上学期10月月考试卷(解析版) 题型:选择题
新型纳米材料氧缺位铁酸盐(MFe2Ox 3<x<4,M=Mn、Co、或Ni)由铁酸盐(MFe2O4)经高温与氢气反应制得,常温下,它能使工业废气中的酸性氧化物(SO2、NO2等)转化为其单质除去,转化流程如图。关于此转化过程的叙述不正确的是 ( )

A.MFe2O4在与H2反应中表现了氧化性
B.若4mol MFe2Ox与1mol SO2恰好完全反应则MFe2Ox中x的值为3.5
C.MFe2Ox与SO2反应中MFe2Ox被还原
D.MFe2O4与MFe2Ox中金属元素化合价改变
查看答案和解析>>
科目:高中化学 来源:2015届辽宁省大连市高三10月月考理综化学试卷(解析版) 题型:选择题
某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份,向其中一份中逐渐加入铜粉,最多能溶解19.2 g(已知硝酸只能被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示。下列分析或结果错误的是
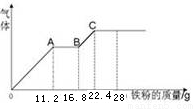
A.原混合液中NO3-的物质的量为0.4mol
B.OA段产生是NO,AB段反应为2Fe3++Fe = 3Fe2+,BC段产生氢气
C.溶液中最终溶质为FeSO4
D.c(H2SO4)为5mol·L-1
查看答案和解析>>
科目:高中化学 来源:2015届辽宁沈阳市高三上学期第一次模拟考试化学试卷(解析版) 题型:选择题
如图所示,6个编号分别表示六种物质:Al、Fe2O3、NaOH溶液、氢碘酸、NH3、O2。凡是直线相连的两种物质均能发生化学反应(已知高温时氨气能还原Fe2O3。)图中⑤表示的物质是

A.Al或Fe2O3 B.NaOH溶液
C.氢碘酸 D.NH3或O2
查看答案和解析>>
科目:高中化学 来源:2015届辽宁沈阳市高三上学期第一次模拟考试化学试卷(解析版) 题型:选择题
设NA为阿伏伽德罗常数的值。下列说法正确的是
A.1.6g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA
B.0.1mol丙烯酸中含有双键的数目为0.1NA
C.标准状况下,11.2L苯中含有分子的数目为0.5NA
D.在过氧化钠与水的反应中,每生成0.1mol氧气,转移电子的数目为0.4NA
查看答案和解析>>
科目:高中化学 来源:2015届贵州省贵阳市高三年级8月摸底考试化学试卷(解析版) 题型:填空题
(14分)某配位化合物为深蓝色晶体,由原子序数依次增大的A、B、C、D、E五种非0族元素组成,其原子个数比为14:4:5:1:1.其中A是元素周期表中原子半径最小的元素,C、D元素同主族且原子序数D为C的二倍,E元素的原子外圈电子排布为(n-l)dn+6nsl 。 请回答下列问题:
(1)元素D在周期表中的位置是____________________;
(2)该配位化合物的化学式为____________________;
(3)A元素可分别与B、C、D元素化合形成三种电子数相等的分子,它们分别为________;其中A元素与B元素可形成分子式为A2B2的某化合物,该化合物的分子具有平面结构,则其结构式为_____________;
(4)EDC4常作电镀液,其中DC42-的空间构型是________.其中D原子的杂化轨道类型是_____________;
(5)已知E的晶胞结构如下图所示,又知晶胞边长为3.61 10-8cm,则E的密度为______________________.
10-8cm,则E的密度为______________________.

查看答案和解析>>
科目:高中化学 来源:2015届贵州省贵阳市高三年级8月摸底考试化学试卷(解析版) 题型:填空题
(10分)工业制氢气的一个重要反应是:CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
(1)已知在25。C时:
① C(石墨)+1/2O2(g)=CO(g) △H1=-111kJ·mol-1
② C(石墨)+O2(g)=CO2(g) △H2=-394kJ·mol-1
③ H2(g)+1/2O2(g)=H2O(g) △H3=-242kJ·mol-1
则反应CO(g)+H2O(g) === CO2(g)+H2(g)的反应热△H=___________.
(2)现将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:

①以下反应能说明CO(g)+H2O(g)  CO2(g)+H2(g)达到平衡状态的是_________
CO2(g)+H2(g)达到平衡状态的是_________
A.容器中CO的含量保持不变 B.容器中CO2浓度与CO浓度相等
C. (CO)=
(CO)= (H2O) D.容器中混合气体的平均相对分子质量保持不变
(H2O) D.容器中混合气体的平均相对分子质量保持不变
②实验I中,从反应开始到反应达到平衡时,CO的平均反应速率 (CO)=_____;
(CO)=_____;
③实验II条件下反应的平衡常数K=_____________(保留小数点后二位);
④实验III中,若平衡时,CO的转化率大于水蒸气,则a,b必须满足的关系是______;
⑤若在900℃时,实验II反应达到平衡后,向此容器中再加入1molCO、0.5mol H2O、0.2mol CO2、0.5mol H2,则此时 ___________
___________ (填“>”或“<”),平衡向__________方向移动(填“正反应”、“逆反应”“不移动”)
(填“>”或“<”),平衡向__________方向移动(填“正反应”、“逆反应”“不移动”)
查看答案和解析>>
科目:高中化学 来源:2015届福建省高二上学期第二次月考化学试卷(解析版) 题型:填空题
(20分)
(1)已知可逆反应:M(g)+N(g)P(g)+Q(g) ΔH>0,请回答下列问题:
①在某温度下,反应物的起始浓度分别为:c(M)= 1 mol·L-1,c(N)=2.4 mol·L-1,达到平衡后,M的转化率为60%,此时N的转化率为 ;
②若反应温度不变,反应物的起始浓度分别为:c(M)=4 mol·L-1,c(N)=a mol·L-1;达到平衡后,c(P)=2 mol·L-1,a= ;
(2)甲、乙两瓶氨水的浓度分别为1 mol·L-1和0.1 mol·L-1,则甲、乙两瓶氨水中c(OH-)之比_______(填“大于”、“小于”或“等于”)10,说明理由_____________________________ 。
(3)25℃时几种物质的电离度(溶液浓度均为0.1mol/L) 如下表(已知硫酸的第一步电离是完全的):
①H2SO4溶液: HSO4- | ②NaHSO4溶液: HSO4- | ③盐酸 HCl=H++Cl |
10% | 29% | 100% |
25℃时,0.1mol/L上述几种溶液加入完全一样的等量锌粒,反应速率从大到小的顺序
是 (填序号)
②25℃时,c(H+)相同的上述几种溶液,其物质的量浓度由大到小的顺序是 (填序号)
③25℃时,0.1mol/L H2SO4中的HSO4-的电离度小于0.1mol/L NaHSO4中HSO4-的电离度的原因是________________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com