
【题目】根据下列物质变化,所得能量变化关系正确的是
物质变化 | 能量关系 | |
A | 将充满NO2的针筒置于热水中,气体颜色变深 | 1molN2O4(g)的能量>2molNO2(g)的能量 |
B | 将NaOH溶液与HCl溶液混合 |
|
C | 1g气态SiH4在空气中燃烧,生成SiO2 (s)与液态水,放热44.6kJ | SiH4(g)+2O2(g)→SiO2(s)+2H2O(l)+44.6kJ |
D | 合成氨:N2(g)+3H2(g) | 反应物的总键能>生成物的总键能 |
A.AB.BC.CD.D
【答案】B
【解析】
A. 红棕色变深,说明升高温度,平衡移动,二氧化氮的浓度增大,则说明反应2NO2=N2O4为放热反应,即2mol二氧化氮的总能量高于1mol四氧化二氮的总能量,故A错误;
B. 将NaOH溶液与HCl溶液混合,此反应为放热反应,反应物的总能量高于生成物的总能量,故B正确;
C. 1g气态SiH4在空气中燃烧,生成SiO2(s)与液态水,放热44.6kJ,所以SiH4(g)+2O2(g)→SiO2(s)+2H2O(l)放热Q=32×44.6kJ=1427.2kJ,故C错误;
D. 合成氨:N2(g)+3H2(g)![]() 2NH3(g)+92.4kJ,此反应为放热反应,△H<0,△H=E反应物分子化学键总键能-E生成物分子化学键总键能,则反应物的总键能<生成物的总键能,故D错误;
2NH3(g)+92.4kJ,此反应为放热反应,△H<0,△H=E反应物分子化学键总键能-E生成物分子化学键总键能,则反应物的总键能<生成物的总键能,故D错误;
故选B。


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 烷烃的通式为CnH2n+2,随n值增大,碳元素的质量百分含量逐渐减小
B. 乙烯与溴加成反应的产物为溴乙烷
C. 1 mol苯恰好与3 mol氢气完全加成,说明苯分子中有三个碳碳双键
D. 当n=7,主链上有5个碳原子的烷烃共有5种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将17.6克Fe2O3和Cu的混合物溶解于足量的稀盐酸中,再加铁粉9.8克,待铁粉溶解后,溶液中无Fe3+,此过程共产生2.24升H2(标况),则下列判断正确的是
A.混合物中Cu全部被氧化为Cu2+以后,Cu2+又全部被还原
B.混合物中Cu全部被氧化为Cu2+以后,Cu2+又部分被还原
C.混合物中Cu部分被氧化为Cu2+以后,Cu2+又全部被还原
D.混合物中Cu部分被氧化为Cu2+以后,Cu2+又部分被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铜晶体(CuCl2·2H2O)中含有FeCl2杂质,为制得纯净的氯化铜晶体,首先将其制成水溶液,再按下图所示的操作步骤进行提纯。
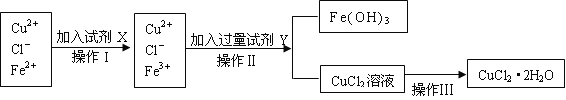
请参照下表给出的数据填空。
氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
Cu2+ | 4.7 | 6.7 |
Fe2+ | 7.0 | 9.0 |
Fe3+ | 1.9 | 3.7 |
(1)操作I加入X的目的是_________________。
(2)下列物质都可以作为X,适合本实验的X物质可以是(填选项)_________ 。
A、KMnO4 B、NaClO C、H2O2 D、Cl2
(3)操作II的Y试剂为____________(填化学式),并调节溶液的pH在______范围。
(4)实验室在配制CuCl2溶液时需加入少许_________(填物质名称),理由是(文字叙述并用有关离子方程式表示)_________________ __________。
(5)若将CuCl2溶液蒸干灼烧,得到的固体是_________________(填化学式);若要得无水CuCl2,请简述操作方法_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硫是造成大气污染的主要有害气体之一,工业制备硫酸的接触室中二氧化硫不能完全转化为三氧化硫,尾气必须处理。某兴趣小组模拟接触室中反应,如图是分别在三种不同实验条件下进行反应,反应物二氧化硫的浓度随时间的变化。
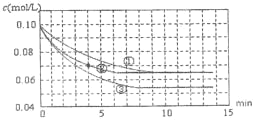
(1)工业制硫酸的接触室中用二氧化硫与氧气制三氧化硫的生产条件为_______。
(2)实验②,0~4min 平均反应速率v(O2)=______。
(3)实验③可能改变的条件是什么:______请简述理由。______(已知正反应放热)
(4)二氧化硫尾气可以用氨水吸收,最终的产物可能有(NH4)2SO4、(NH4)2SO3、NH4HSO3。若三者的物质的量浓度相同时,铵根离子浓度由大到小的顺序为______。
(5)浓硫酸是常见的干燥剂,请解释不能干燥硫化氢与氨气的原因_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,将一根较纯的铁棒垂直没入水中,由于深水处溶氧量较少,一段时间后发现AB段产生较多铁锈,BC段腐蚀严重。下列关于此现象的说法错误的是( )
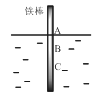
A.该腐蚀过程属于电化腐蚀
B.铁棒AB段电极反应为O2 + 2H2O+ 4e-→ 4OH-
C.铁棒AB段是负极,BC段是正极
D.产生此现象的根本原因是铁棒所处化学环境的不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒容的密闭容器中按照下表甲、乙、丙三种方式分别投料,发生反应:3H2(g)+N2(g) ![]() 2NH3(g),测得甲容器中H2的平衡转化率为 40%,下列说法正确的是( ).
2NH3(g),测得甲容器中H2的平衡转化率为 40%,下列说法正确的是( ).
N2(mol) | H2(mol) | NH3(mol) | |
甲 | 1 | 3 | 0 |
乙 | 0.5 | 1.5 | 1 |
丙 | 0 | 0 | 4 |
A.乙容器中反应向逆向进行
B.达到平衡时,甲、乙、丙三容器中NH3体积分数的大小顺序:甲=乙>丙
C.乙中的NH3转化率为40%
D.若丙在恒温恒压的密闭容器进行,平衡后往容器中再充入4 mol NH3,重新达到平衡时,体系中NH3体积分数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A~G是几种烃分子的球棍模型,据此回答下列问题:
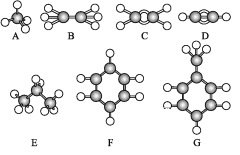
(1)上述七种烃中:
①常温下含碳量最高的气态烃是____(填结构简式)。
②能够发生加成反应的烃有____种。
③与A互为同系物的是____(填对应字母)。
④一卤代物种类最多的是____(填对应字母)。
(2)写出C发生加聚反应的化学方程式:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图装置探究铁在海水中的电化学防护,下列说法不正确的是

A.若X为锌棒,开关K置于M处,可减缓铁的腐蚀
B.若X为锌棒,开关K置于M处,铁电极的反应:Fe2e =Fe2+
C.若X为碳棒,开关K置于N处,可减缓铁的腐蚀
D.若X为碳棒,开关K置于N处,铁电极的反应:2H++2e=H2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com