
已知下列元素原子的半径为:
| 原子 | Nw.w&.w.k. s.5*u.c.#om | Sw.w&.w.k. s.5*u.c.#om | O | Si |
| 半径r/10-10m | 0.75 | 1.02 | 0.74 | 1.17 |
根据以上数据,磷原子的半径可能是
A.0.80×10-10 m B.1.10×10-10 m C.1.20×10-10 m D.0.70×10-10 m
科目:高中化学 来源: 题型:阅读理解
 (2009?宿迁二模)聚合铁(简称PFS)化学式为:[Fe2(OH)n(SO4) 3-
(2009?宿迁二模)聚合铁(简称PFS)化学式为:[Fe2(OH)n(SO4) 3-| n | 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
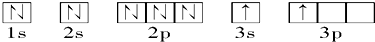
查看答案和解析>>
科目:高中化学 来源:2009年江苏省宿迁市高考化学二模试卷(解析版) 题型:解答题
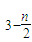 ]m,n<5,m<10.现代污水处理工艺中常利用PFS在水体中形成絮状物,以吸附重金属离子.
]m,n<5,m<10.现代污水处理工艺中常利用PFS在水体中形成絮状物,以吸附重金属离子. 
查看答案和解析>>
科目:高中化学 来源:2009年广东省梅州中学高考化学模拟试卷(解析版) 题型:解答题
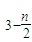 ]m,n<5,m<10.现代污水处理工艺中常利用PFS在水体中形成絮状物,以吸附重金属离子.
]m,n<5,m<10.现代污水处理工艺中常利用PFS在水体中形成絮状物,以吸附重金属离子. 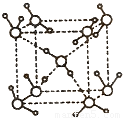
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com