
| A. | 150mL | B. | 200mL | C. | 450mL | D. | 无法计算 |
分析 Al、Fe合金与硝酸反应生成硝酸盐与NO,再向反应后的溶液中加入NaOH溶液,使铝、铁元素刚好全部转化为沉淀,此时溶液中溶质为NaNO3,由N元素守恒计算n(HNO3),根据钠离子守恒可知n(NaOH)=n(NaNO3),再根据V=$\frac{n}{c}$计算需要氢氧化钠溶液的体积.
解答 解:Al、Fe合金与硝酸反应生成硝酸盐与NO,再向反应后的溶液中加入NaOH溶液,使铝、铁元素刚好全部转化为沉淀,此时溶液中溶质为NaNO3,由N元素守恒计算n(NaNO3)=0.3L×2mol/L-$\frac{3.36L}{22.4L/mol}$=0.45mol,根据钠离子守恒可知n(NaOH)=n(NaNO3)=0.45mol,
所以需要3mol/L的氢氧化钠溶液的体积为:$\frac{0.45mol}{3mol/L}$=0.15L=150mL,
故选A.
点评 本题考查混合物的有关计算,难度中等,明确反应发生的过程是关键,注意利用守恒思想进行的解答,试题有利于提高学生的分析能力及化学计算能力.


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:选择题
| A. | C原子外围电子排布图: | B. | 硫原子结构示意图: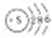 | ||
| C. | 二氧化硅的分子式:SiO2 | D. | 苯的比例模型: |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
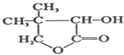 ,G的合成路线如下:
,G的合成路线如下: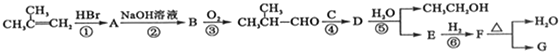
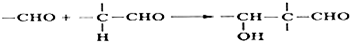
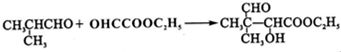 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 建造三峡大坝使用了大量水泥,水泥属于硅酸盐材料 | |
| B. | 人造刚玉熔点很高,可用作高级耐火材料,主要成分是SiO2 | |
| C. | 太阳能电池板中的硅在元素周期表中处于金属与非金属的交界位置 | |
| D. | 金属冶炼的本质是金属阳离子得到电子变成金属原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | R和N元素的原子含有相同数目的未成对电子 | |
| B. | RO3-中R的化合价与NO3-中的N的化合价不相等 | |
| C. | RO3-和NO3-只能被还原,不能被氧化 | |
| D. | R原子的电子层数比N的电子层数多1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新制氯水中只含氯气和水分子 | |
| B. | 新制氯水可使蓝色石蕊试纸先变红后褪色 | |
| C. | 光照氯水有气泡逸出,该气体是氯气 | |
| D. | 氯水放置数天后pH将变大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
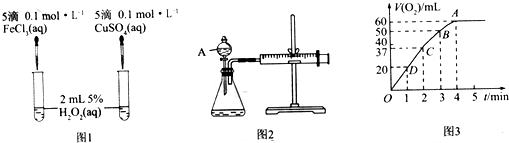
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com