
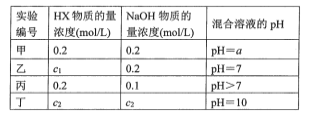
【题目】常温下,将某一元酸HX和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
请回答:
(1)不考虑其他组的实验结果,单从甲组情况分析,若a ___7(填“>”“<”或“=”),则HX为强酸;若a ____ 7(填“>”“<”或“=”),则HX为弱酸。
(2)在乙组混合溶液中离子浓度c(X-)与c(Na+)的大小关系是____。
A.前者大 B.后者大 C.二者相等 D.无法判断
(3)从丙组实验结果分析,HX是___ 酸(填“强”或“弱”)。
(4)丁组实验所得混合溶液中由水电离出的c(OH-)=__mol/L。
【答案】= > C 弱 10-4
【解析】
(1)等体积、等浓度的一元酸和氢氧化钠恰好反应生成盐,根据盐溶液的酸碱性判断盐的类型,从而确定酸的强弱;(2)根据电荷守恒判断;(3)酸的浓度是碱的2倍,等体积混合时,溶液中的溶质是酸和盐,溶液呈碱性,说明酸根离子的水解程度大于酸的电离程度;(4)等浓度等体积的一元酸和氢氧化钠恰好反应生成盐,根据溶液的pH计算氢离子浓度,再根据水的离子积常数计算氢氧根离子浓度。
(1)等体积、等浓度的一元酸和氢氧化钠恰好反应生成盐,如果盐溶液呈中性,则盐是强酸强碱盐,酸是强酸,如果盐溶液呈碱性,则盐是强碱弱酸盐,酸是弱酸,故答案为:=;>;
(2)溶液中存在电荷守恒,c(X-)+c(OH-)=c(H+)+c(Na+),溶液呈中性,则c(OH-)=c(H+),所以c(X-)=c(Na+),故选C;
(3)酸的浓度是碱的2倍,等体积混合时,溶液中的溶质是酸和盐,溶液呈碱性,说明酸是弱酸;故答案为:弱;
(4)等浓度等体积的一元酸和氢氧化钠恰好反应生成盐,溶液中氢离子浓度为1×10-10 mol/L,根据水的离子积常数知,氢氧根离子浓度为10-4mol/L,故答案为:10-4。


 优等生题库系列答案
优等生题库系列答案科目:高中化学 来源: 题型:
【题目】设阿伏加德罗常数的值为NA。已知:在无氧条件下,葡萄糖发生反应C6H12O6![]() 2CH3CH2OH+2CO2↑。下列说法正确的是( )
2CH3CH2OH+2CO2↑。下列说法正确的是( )
A. 0.1 mol葡萄糖(C6H12O6)含羟基(—OH)数目为0.6NA
B. 10.0 g质量分数为46%的酒精与足量的钠反应产生氢分子数为0.05NA
C. 常温常压下,4.48 L CO2和NO2的混合气体含原子总数为0.6NA
D. 4.8 g Mg在足量的CO2中完全燃烧,转移电子数目为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中含有NO2、NO和CO等有害气体,现取标准状况下22.4 L汽车尾气,研究发现该气体通过催化转化器后,上述三种有害气体可被完全转化为无害的N2和CO2,再取等体积尾气通入0.1 mol/L 50 mL NaOH溶液中,其中的NO2和NO恰好被完全吸收。则尾气中CO的体积分数可能为(说明:汽车尾气中其它成分气体与CO和NaOH溶液均不反应)( )
A. 0.4% B. 0.8% C. 2% D. 4%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,在25 mL 0.1 mol·L-1NaOH溶液中逐滴加入0.2 mol·L-1CH3COOH溶液,pH与滴加CH3COOH溶液体积的关系曲线如下图所示,若忽略两溶液混合时的体积变化,下列有关粒子浓度关系的说法错误的是( )

A. 在A、B间任一点,溶液中一定都c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
B. 在B点:a>12.5,且有c(Na+)=c(CH3COO-)>c(OH-)=c(H+)
C. 在C点:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
D. 在D点:c(CH3COO-)+c(CH3COOH)=0.1mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.1molL-1CH3COOH溶液中存在如下电离平衡:CH3COOH![]() CH3COO-+H+,对于该平衡,下列叙述正确的是
CH3COO-+H+,对于该平衡,下列叙述正确的是
A. 加入水时,平衡向逆反应方向移动
B. 加入少量CH3COONa固体,平衡向逆反应方向移动,c(CH3COO-)增大
C. 加入少量0.1 molL-1HCl溶液,平衡向逆反应方向移动,溶液中c(H+)减小
D. 加入少量NaOH固体,平衡向正反应方向移动,酸性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】11、浓度均为 ![]() 的
的![]() 和
和 ![]() ,在一定条件下发生反应
,在一定条件下发生反应![]()
![]()
![]() ,测得
,测得![]() 的平衡转化率与温度及压强的关系如图所示。下列说法不正确的是
的平衡转化率与温度及压强的关系如图所示。下列说法不正确的是
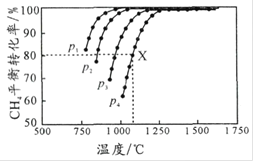
A.平衡时CO与![]() 的物质的量比为
的物质的量比为![]()
B.![]() 由大到小的顺序为
由大到小的顺序为 ![]()
C.![]() , p
, p![]() 条件下,该反应
条件下,该反应![]() 时达到平衡点X,则
时达到平衡点X,则 ![]()
D.随着温度升高,该反应的平衡常数减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在2L的密闭容器中,加入1molX(g)和2molY(g)发生反应:X(g)+m Y(g)![]() 3Z(g),平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1molZ(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是
3Z(g),平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1molZ(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是
A. m=2
B. 两次平衡的平衡常数相同
C. X与Y的平衡转化率之比为1:1
D. 第二次平衡时,Z的浓度为0.4 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸(HNO2)是一元弱酸,不稳定,只能存在于较低温度的稀溶液中。室温时,亚硝酸(HNO2)的电离平衡常数Ka=5.1×10-4,H2CO3的电离平衡常数Ka1=4.2×10-7、Ka2=5.61×10-11。亚硝酸及其盐在实验和工业生产中有重要应用。请回答:
(1)在酸性条件下,NaNO2与KI按物质的量1︰1恰好完全反应,I-被氧化为I2,写出该反应的离子方程式________________。
(2)NaNO2溶液呈_____性(填“酸”“碱”或“中”),原因是________(用离子方程式表示)。要得到稳定HNO2溶液,可以往冷冻的浓NaNO2溶液中加入或通入某种物质,下列物质不适合使用______(填序号)。
a.稀H2SO4 b.CO2 c.SO2
(3)若用电解法将废水中NO2-转换为N2除去,N2将在__________(填电极名称)生成。
(4)向含1 mol Na2CO3的溶液中加入1 mol HNO2后,c(CO32-)、c(HCO3-)、c(NO2-)由大到小的顺序为________________。
(5)25℃时,用0.100molL-1NaOH溶液滴定20.0mL某浓度的HNO2溶液,溶液的pH与NaOH溶液体积(V)的关系如图所示,(在该条件下HNO2不分解)

已知:M点对应溶液中,c(OH-)=c(H+)+c(HNO2)。则:
①原溶液中c(HNO2)为_________。
②下列关于N点对应溶液的说法正确的是______(填选项字母)。
A.溶质只有NaNO2
B.水电离出来的c(H+)=1×10-7 molL-1
C.溶液中:c(Na+)<c(OH-)
D.溶液中离子浓度:c(Na+)= c(NO2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醇酸树脂是一种成膜性好的树脂,如图是一种醇酸树脂的合成线路:

已知:RCH2CH=CH2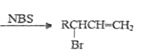
RCH2OH![]() R-CHO
R-CHO RCOOH
RCOOH
(1)醇酸树脂中含有的官能团名称为______________。
(2)写出B的结构简式是______________。
(3)反应①~⑤中属于取代反应的是___________(填序号)。
(4)写出由C→D化学方程式_________________________。
(5)与 互为同分异构体能同时满足下列条件的共有_________种。
互为同分异构体能同时满足下列条件的共有_________种。
a.苯环上有两个取代基 b.属于酚类
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com