
| A. | 聚乙烯食品袋耐高温加热 | |
| B. | 石英玻璃仪器耐酸碱腐蚀 | |
| C. | 羊毛织物可用强碱性洗涤剂清洗 | |
| D. | 把铅加入锡中制造焊锡的目的是降低熔点 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
 ,分子的立体构型为V型,中心原子的杂化轨道类型为sp3杂化.
,分子的立体构型为V型,中心原子的杂化轨道类型为sp3杂化.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
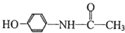 ,下列关于扑热息痛的描述正确的是( )
,下列关于扑热息痛的描述正确的是( )| A. | 分子式为C8H10NO2 | |
| B. | 扑热息痛易溶于水 | |
| C. | 能与Na2CO3溶液反应,但不能与NaHCO3溶液反应 | |
| D. | 属于芳香烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | A | B | C | D |
| 操作或装置 |  | 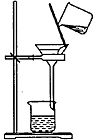 | 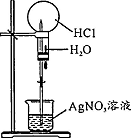 | 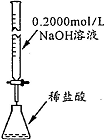 |
| 目的 | 配制一定物质的量浓度溶液 | 分离Na2CO2溶液和CH3COOC2H5的混合物 | 做“白色”喷泉实验 | 用NaOH溶液滴定稀盐酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C4H10有三种同分异构体 | |
| B. | 乙醇、乙二醇、丙三醇互为同系物,同系物之间不可能为同分异物体 | |
| C. | 常温下2S2O(g)=3S(s)+SO2(g)能自发进行,可推断该反应为放热反应 | |
| D. | 因为合金在潮湿的空气中易形成原电池,所以合金耐腐蚀性都较差 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
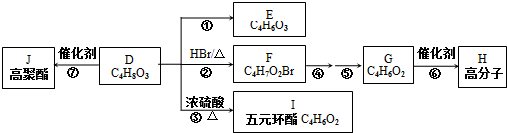
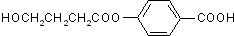 、I
、I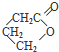 、J
、J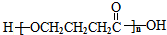 .
. .
. .
.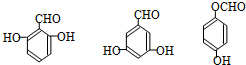 任意一种.
任意一种.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
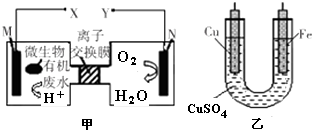
| A. | 铜电极应与X相连接 | |
| B. | H+透过离子交换膜由N极向M极移动 | |
| C. | M电极反应式:(C6H10O5)n+7n H2O-24n e-═6n CO2↑+24n H+ | |
| D. | 当N电极消耗0.25 mol气体时,则铁电极增重16 g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  为证明非金属性强弱:S>C>Si | |
| B. | 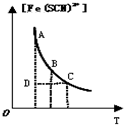 表示可逆反应Fe3+(aq)+SCN-(aq)?Fe(SCN)2+(aq)平衡时,物质的量浓度[Fe(SCN)2+]与温度T的关系,反应处于D点时,一定有V(正)<V(逆) | |
| C. | 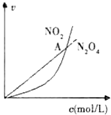 表示恒温恒容条件下发生的可逆反应2NO2(g)?N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态 | |
| D. | 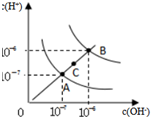 为水的电离平衡曲线图,若从A点到C点,可在水中加入适量NaOH固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 碱金属元素的阳离子随核电荷数增加,氧化性渐弱而还原性渐强 | |
| B. | 碱金属元素的原子半径越大,越易失电子,其单质还原性越强 | |
| C. | 随核电荷数增多,碱金属单质的熔点一定渐低,密度一定渐大 | |
| D. | 碱金属单质的金属性强,均易与Cl2、O2、N2等发生反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com