

分析 (1)①同周期自左而右电负性增大,Cl、O形成的化合物中O元素表现负价,对键合电子吸引更大;
②COCl2分子中所有原子均满足8电子构型,结构式为 ,单键为σ键,双键含有1个σ键和、1个π键,C原子形成3个σ键,没有孤对电子,杂化轨道数目为3;
,单键为σ键,双键含有1个σ键和、1个π键,C原子形成3个σ键,没有孤对电子,杂化轨道数目为3;
(2)离子电荷相等,离子半径越小,晶格能越大,熔沸点越高;
(3)①根据均摊法计算晶胞中Ni、La原子数目,进而确定化学式;
②结合晶胞含有原子数目,表示出晶胞质量,结合m=ρV计算晶胞体积;
(4)①Cu的核外电子数为29,处于周期表中第四周期IB族;
②Cu原子堆积方式为面心立方密堆积;
(5)某M原子的外围电子排布式为3S23p5,则M为Cl.
①根据均摊法计算晶胞中Cu、Cl原子数目,进而确定化学式;
②一般两个元素的电负性相差大于1.7的两种元素形成化合物时形成离子键,小于1.7的两种元素形成共价键;
③Cu原子与周围的4个Cl原子形成正四面体结构,四面体中心Cu原子与顶点氯原子距离最近,四面体中心的Cu原子与晶胞顶点Cl原子连线处于晶胞体对角线上,且距离为体对角线长度的$\frac{1}{4}$,而体对角线长度为晶胞棱长的$\sqrt{3}$倍,结合晶胞含有原子数目表示出晶胞质量,结合m=ρV计算.
解答 解:(1)①同周期自左而右电负性增大,Cl、O形成的化合物中O元素表现负价,对键合电子吸引更大,氧元素电负性大于Cl的,故电负性:O>Cl>C,
故答案为:O>Cl>C;
②COCl2分子中所有原子均满足8电子构型,结构式为 ,单键为σ键,双键含有1个σ键和、1个π键,则σ键和π键的个数比为3:1,C原子形成3个σ键,没有孤对电子,杂化轨道数目为3,采取sp2杂化,
,单键为σ键,双键含有1个σ键和、1个π键,则σ键和π键的个数比为3:1,C原子形成3个σ键,没有孤对电子,杂化轨道数目为3,采取sp2杂化,
故答案为:3:1;sp2杂化;
(2)NiO、FeO的晶体结构均与氯化钠的晶体结构相同,均属于离子化合物,离子电荷相等,Ni2+的离子半径小于Fe2+的离子半径,故NiO的晶格能大于FeO的晶格能,故熔沸点NiO>FeO,
故答案为:>;
(3)①晶胞中Ni处于体心与面上,La处于顶点,则晶胞中Ni原子数目为1+8×$\frac{1}{2}$=4、La原子数目为8×$\frac{1}{8}$=1,故化学式为:LaNi5,
故答案为:LaNi5;
②该物质的摩尔质量M gmol-1,晶胞质量为$\frac{M}{{N}_{A}}$g,密度为d gcm-3,则该晶胞的体积是$\frac{M}{{N}_{A}}$g÷d gcm-3=$\frac{M}{d{N}_{A}}$cm3,
故答案为:$\frac{M}{d{N}_{A}}$;
(4)①Cu的核外电子数为29,处于周期表中第四周期IB族,价电子排布式为:3d104s1,
故答案为:3d104s1;
②Cu原子堆积方式为面心立方密堆积,以顶点原子为研究,与之相邻的原子出面心,每个顶点为8个晶胞共用,每个面心为2个晶胞共用,则其周围距离最近的铜原子数目为$\frac{3×8}{2}$=12,
故答案为:12;
(5)某M原子的外围电子排布式为3S23p5,则M为Cl.
①根据均摊法,晶胞中Cu原子数目为4、Cl原子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,则化学式为CuCl,
故答案为:CuCl;
②铜和Cl电负性分别为1.9和3.0,二者电负性相差3.0-1.9=1.1<1.7,则CuCl属于共价化合物,
故答案为:共价;
③Cu原子与周围的4个Cl原子形成正四面体结构,四面体中心Cu原子与顶点氯原子距离最近,四面体中心的Cu原子与晶胞顶点Cl原子连线处于晶胞体对角线上,且距离为体对角线长度的$\frac{1}{4}$,而体对角线长度为晶胞棱长的$\sqrt{3}$倍,晶胞质量为4×$\frac{64+36.5}{{N}_{A}}$g,设晶胞棱长为a cm,则4×$\frac{64+36.5}{{N}_{A}}$g=pgcm-3×(a cm)3,解得a=$\root{3}{\frac{4×(64+36.5)}{p{N}_{A}}}$,则该晶体中铜元子与M原子之间的最短距离为$\frac{1}{4}$×$\sqrt{3}$×$\root{3}{\frac{4×(64+36.5)}{p{N}_{A}}}$cm=$\frac{1}{4}$×$\sqrt{3}$×$\root{3}{\frac{4×(64+36.5)}{p{N}_{A}}}$×1010cm,
故答案为:$\frac{1}{4}$×$\sqrt{3}$×$\root{3}{\frac{4×(64+36.5)}{p{N}_{A}}}$×1010.
点评 本题是对物质结构与性质的考查,涉及电负性、化学键、杂化方式、晶体类型与性质、晶胞计算等,注意根据氧化物判断氧与氯的电负性,(5)中计算为难点,需要学生具备一定的空间想象与数学计算能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ①② | C. | ②③ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
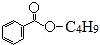 ,下列说法错误的是( )
,下列说法错误的是( )| A. | X难溶于水 | B. | X的分子式为C11H14O2 | ||
| C. | 组成为-C4H9的烃基有3种 | D. | X能发生加成反应、取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氨是重要的化工原料,用途广泛.
氨是重要的化工原料,用途广泛. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸、纯碱、漂白粉 | B. | 硫酸、烧碱、小苏打 | ||
| C. | 硫酸氢钠、生石灰、醋酸钠 | D. | 磷酸、熟石灰、苛性钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 32g氧气与足量锂完全反应得到的电子数为2NA | |
| B. | 在1L2mol•L-1MgCl2溶液中含有的Cl-数为2NA | |
| C. | 标准状态下,2.24LCO2与2.24LH2O中所含原子数均为0.3NA | |
| D. | 标准状况下,11.2L氯气与足量NaOH溶液反应转移的电子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
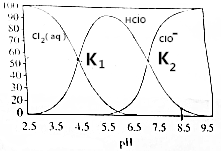
| A. | n(Cl2)、n(HClO)和n(ClO-)之和不随pH变化而变化 | |
| B. | 当pH逐渐增大时,HClO先增大后减小 | |
| C. | 当pH>8.5时,c(H+)=c(OH-)+c(ClO-)+c(Cl-) | |
| D. | K1、K2均是通过曲线交点计算得出的酸的电离平衡常数 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com