
 (1)为了检验某含有NaHCO3杂质的Na2CO3样品的纯度,现将100g样品加热使其质量不再变化,其质量变为96.9%,则该样品的纯度(质量分数)是91.6%
(1)为了检验某含有NaHCO3杂质的Na2CO3样品的纯度,现将100g样品加热使其质量不再变化,其质量变为96.9%,则该样品的纯度(质量分数)是91.6%分析 (1)碳酸氢钠加热分解生成碳酸钠、二氧化碳气体和水,利用差量法计算出该样品的纯度;
(2)利用差量法,根据化学方程式分析:CO与H2在氧气中完全燃烧,生成CO2和H2O,生成的CO2和H2O再与Na2O2反应,
2CO+O2 $\frac{\underline{\;点燃\;}}{\;}$2CO2,一氧化碳与二氧化碳物质的量相等,Na2O2与CO2反应2CO2+2Na2O2=2Na2CO3+O2,
质量增重为:△m=2Na2CO3-2Na2O2=2CO,反应后固体质量增加量为CO的质量;
2H2+O2 $\frac{\underline{\;点燃\;}}{\;}$2H2O,生成的水与氢气物质的量相等,Na2O2与H2O反应2H2O+2Na2O2=4NaOH+O2,质量增重为:△m=2H2O-O2=2H2,反应后固体增加的质量为氢气质量,
根据以上分析可知,CO、H2与足量氧气反应后的产物再与过氧化钠反应,过氧化钠增重的为原CO和H2组成混合气体的质量;
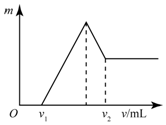
(3)根据图象可知,在滴加NaOH溶液到体积V1=70mL过程中,没有沉淀生成,说明硫酸有剩余,滴加的NaOH用于中和剩余硫酸,V1=70mL时,剩余的H2SO4与滴加的NaOH恰好完全反应,溶液是MgSO4、Al2(SO4)3和Na2SO4混合液,令MgSO4为xmol,Al2(SO4)3为ymol,根据守恒列方程求算n(Mg);
当滴加NaOH溶液到体积V2时,Al(OH)3完全溶解,沉淀是Mg(OH)2,溶液是Na2SO4和NaAlO2混合液.根据守恒,有n(NaOH)=2n(Na2SO4)+n(NaAlO2)=2n(H2SO4)+n(Al),据此求出n(NaOH),再利用V=$\frac{n}{c}$计算.
解答 解:(1)其质量变为原先的96.9%,则质量减少了:100g×(1-96.9%)=3.1g,
设样品中含有NaHCO3杂质的质量为x,则
2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O?△m(减少)
2×84 62
x 3.1g
x=$\frac{3.1g×168}{62}$=8.4g,
所以该样品的纯度(质量分数)为:$\frac{100g-8.4g}{100g}$×100%=91.6%,
故答案为:91.6%;
(2)CO与H2在氧气中完全燃烧,生成CO2和H2O,生成的CO2和H2O再与Na2O2反应,
①2CO+O2 $\frac{\underline{\;点燃\;}}{\;}$2CO2,一氧化碳与二氧化碳物质的量相等,Na2O2与CO2反应2CO2+2Na2O2=2Na2CO3+O2,质量增重为:△m=2Na2CO3-2Na2O2=2CO,反应后固体质量增加量为CO的质量;
②2H2+O2 $\frac{\underline{\;点燃\;}}{\;}$2H2O,生成的水与氢气物质的量相等,Na2O2与H2O反应2H2O+2Na2O2=4NaOH+O2,质量增重为△m=2H2O-O2=2H2,反应后固体增加的质量为氢气质量,
根据①②分析可知,CO、H2与足量氧气反应后的产物再与过氧化钠反应,过氧化钠增重的为原CO和H2组成混合气体的质量,所以固体质量增加了2.1g,
故答案为:2.1g;
(3)当V1=70mL时,此时,溶液是MgSO4、Al2(SO4)3和Na2SO4混合液,
由Na+离子守恒可知,n(Na2SO4)=$\frac{1}{2}$n(NaOH)=$\frac{1}{2}$×0.07L×1mol/L=0.035mol
令MgSO4为xmol,Al2(SO4)3为ymol,则:
根据Mg原子、Al原子守恒有:x+2y=0.1
根据SO42-离子守恒有:x+3y=0.1×1.5-0.035
联立方程,解得:x=0.07、y=0.015
所以金属粉末中n(Mg)=0.07mol,n(Al)=2y=2×0.02mol=0.04mol,
滴加NaOH溶液到体积V2时,溶液是Na2SO4和NaAlO2混合液,
根据质量守恒有:n(NaOH)=2n(Na2SO4)+n(NaAlO2)=2n(H2SO4)+n(Al)=2×0.1L×1.5mol/L×+0.03mol=0.33mol,所以V2=$\frac{0.33mol}{1mol/L}$=0.33L=330ml,
故答案为:0.07;330.
点评 本题考查了混合物反应的计算、离子反应的计算,题目难度中等,明确图象曲线变化的含义为解答关键,注意掌握守恒思想在化学计算中的应用方法,试题培养了学生的化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 锌为电池负极,发生氧化反应 | |
| B. | 电池工作时,氧气与锌直接化合,生成氧化锌 | |
| C. | 正极发生的反应是:$\frac{1}{2}$O2+2e-+2H+═H2O | |
| D. | 负极发生的反应是:Zn-2e-+H2O═ZnO+2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 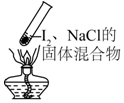 加热时,上部汇聚了固体碘,说明碘的热稳定性较差 | |
| B. | 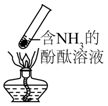 加热时,中部溶液变红,冷却后又变为无色 | |
| C. |  加热时,中部溶液变红,冷却后又变为无色 | |
| D. |  \加热时,上部汇聚了白色固体,说明氯化铵易升华 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
| 编号 | ① | ② | ③ | ④ |
| 稀硝酸体积/ml | 100mL | 200mL | 300mL | 400mL |
| 剩余金属/g | 18.0g | 9.6g | 0 | 0 |
| NO体积/L | 2.24L | 4.48L | 6.7L | V |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用稀硫酸溶解四氧化三铁:Fe3O4+8H+═Fe2++2Fe3++4H2O | |
| B. | Ca(HCO2)2溶液中滴加Ba(OH)2溶液至呈中性:Ca2++2HCO3-+Ca2++2OH-═2H2O+BaCO3↓+CaCO3↓ | |
| C. | 向NaHSO4溶液中滴加Ba(OH)2溶液至呈中性:H++SO42-+Ba2++OH-═H2O+BaSO4↓ | |
| D. | 向次氯酸钠溶液中通入SO2:2ClO-+SO2+H2O═SO32-+2HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LCl2溶于水,Cl2和水反应时转移电子数为NA | |
| B. | 标准状况下,40gSO3中含有分子的数目为0.5NA | |
| C. | 标准状况下,2.24L由乙烯和聚乙烯组成的混合物中含有原子的数目为0.6NA | |
| D. | 常温常压下,10g46%酒精水溶液中含氧原子总数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 28 g氮气含有的原子数为NA | |
| B. | 标准状况下,22.4 L水中含有的水分子数为NA | |
| C. | 1 molOH-含有的电子数为10NA | |
| D. | 0.1 L 1 mol•L-1NaCl溶液中含有Na+个数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,HCN中C的化合价为-2.
,HCN中C的化合价为-2.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
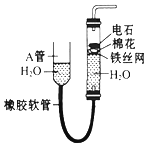 如图中的实验装置可用于制取乙炔.请填空:
如图中的实验装置可用于制取乙炔.请填空:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com