

| 温度 实验次数 | 起始温度t1/℃ | 终止温度t℃/℃ | 温度差平均值(t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | 4.0 |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
分析 (1)依据热化学方程式和盖斯定律计算得到甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式;
(2)①通电后,将Co2+氧化成Co3+,电解池中阳极失电子发生氧化反应;
②在反应6Co3++CH3OH+H2O=CO2↑+6Co2++6H+中,碳从-2价被氧化成+4价,每产生1个二氧化碳,转移6个电子,据此解答;
(3)①先判断温度差的有效性,然后求出温度差平均值;
②先根据Q=m•c•△T计算反应放出的热量,然后根据△H=-$\frac{Q}{n}$kJ/mol计算出反应热;
③a.装置保温、隔热效果差,热量散失;
b.量取NaOH溶液的体积时仰视读数,会导致所量的氢氧化钠体积偏大;
c.用环形铜丝搅拌棒搅拌溶液,热量散失;
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度,硫酸的起始温度偏高.
解答 解:(1)①2CH3OH(I)+3O2(g)═2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②2CO(g)+O2(g)═2CO2(g)△H=-566.0kJ/mol
③H2O(g)═H2O(I)△H=-44.0kJ/mol
依据盖斯定律计算:①-②+③×4得到甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ/mol
故答案为:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ/mol;
(2)①通电后,将Co2+氧化成Co3+,电解池中阳极失电子发生氧化反应,电极反应为:Co2+-e-=Co3+;
故答案为:Co2+-e-=Co3+;
②在反应6Co3++CH3OH+H2O=CO2↑+6Co2++6H+中,碳从-2价被氧化成+4价,每产生1个二氧化碳,转移6个电子,标况下产生2.24LCO2时,即0.1mol,共转移电子数0.6mol,
故答案为:碳;0.6.
(3)①4次温度差分别为:4.0℃,4.1℃,3.9℃,4.1℃,4组数据都有效,温度差平均值=$\frac{4.0℃+4.1℃+3.9℃+4.1℃}{4}$=4.0℃;
故答案为:4.0;
②0.50mol/LNaOH溶液50mL和0.50mol/L硫酸溶液30mL进行中和反应生成水的物质的量为0.05L×0.50mol/L=0.025mol,溶液的质量为80ml×1g/ml=80g,温度变化的值为△T=4.0℃,则生成0.025mol水放出的热量为Q=m•c•△T=80g×4.18J/(g•℃)×4.0℃=1337.6J,即1.3376KJ,所以实验测得的中和热△H=-$\frac{1.3376KJ}{0.025mol}$=-53.5 kJ/mol;
故答案为:-53.5kJ/mol;
③a.装置保温、隔热效果差,热量散失,测得的热量偏小,中和热的数值偏小,故a正确;
b.量取NaOH溶液的体积时仰视读数,会导致所量的氢氧化钠体积偏大,放出的热量偏高,中和热的数值偏大,故b错误;
c.用环形铜丝搅拌棒搅拌溶液,热量散失,中和热的数值偏小,故c正确;
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度,硫酸的起始温度偏高,温度差偏小,测得的热量偏小,中和热的数值偏小,故d正确.
故答案为:acd.
点评 本题主要考查学生盖斯定律的应用、原电池原理、氧化还原反应原理以及中和热的测定,掌握原理是解题关键,侧重学生运用知识的能力,题目难度中等.


科目:高中化学 来源: 题型:解答题
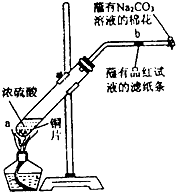 在一支试管中放入一块很小的铜片,再加入少量浓硫酸,然后把试管固定在铁架台上.把一小条蘸有品红溶液的滤纸放入带有单孔橡皮塞的玻璃管中.塞紧试管口,在玻璃导管口处缠放一团蘸有Na2CO3溶液的棉花.给试管加热,观察现象.当试管中的液体逐渐透明时,停止加热.回答下列问题:
在一支试管中放入一块很小的铜片,再加入少量浓硫酸,然后把试管固定在铁架台上.把一小条蘸有品红溶液的滤纸放入带有单孔橡皮塞的玻璃管中.塞紧试管口,在玻璃导管口处缠放一团蘸有Na2CO3溶液的棉花.给试管加热,观察现象.当试管中的液体逐渐透明时,停止加热.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
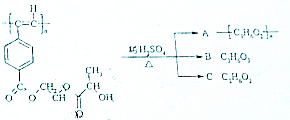 聚乙炔导电聚合物的合成使高分子材料进入了“合成金属”和塑料电子学时代,如图是聚乙炔衍生物分子M的结构式及M在稀硫酸作用下的水解示意图:
聚乙炔导电聚合物的合成使高分子材料进入了“合成金属”和塑料电子学时代,如图是聚乙炔衍生物分子M的结构式及M在稀硫酸作用下的水解示意图: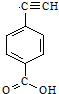 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氟氯烃是一类含氟和氯的卤代烃 | |
| B. | 氟氯烃的化学性质不稳定,有毒 | |
| C. | 氟氯烃大多数无色、无臭、无毒 | |
| D. | 在平流层,氟氯烃在紫外线照射下,分解产生的氯原子可引发损耗O3的循环反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用湿润的pH试纸测稀碱液的pH值,测定值偏小 | |
| B. | 用容量瓶配制溶液,定容时仰视刻度线,所配溶液浓度偏大 | |
| C. | 用盐酸标准溶液滴定未知浓度的NaOH溶液时,若滴定前滴定管内无气泡,终点读数时有气泡,则所测NaOH溶液的浓度偏大 | |
| D. | 测定中和反应的反应热时,将碱缓慢倒入酸中,所测温度值偏高 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
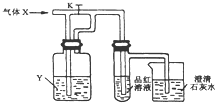
| A. | X是SO2,Y是饱和NaHCO3 溶液 | B. | X是H2S,Y是浓H2SO4 | ||
| C. | X是CO2,Y是Na2SO3 溶液 | D. | X是Cl2,Y是Na2CO3溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com