
分析 (1)根据n=cV计算出碳酸钠的物质的量,再根据m=nM计算出需要碳酸钠的质量;
(2)根据稀释过程中溶质的物质的量不变计算出稀释后溶液浓度.
解答 解:(1)500mL 0.2mol/LNa2CO3溶液中碳酸钠的物质的量为:0.2mol/L×0.5L=0.1mol,需要碳酸钠的质量为:106g/mol×0.1mol=10.6g,
答:配制500mL 0.2mol/LNa2CO3溶液需要的Na2CO3质量是10.6 g;
(2)取上述溶液20mL稀释成100mL后,稀释过程中碳酸钠的物质的量不变,则稀释后碳酸钠的物质的量浓度为:$\frac{0.2mol/L×0.02L}{0.1L}$=0.04mol/L,
答:稀释后溶液的浓度为0.04mol/L.
点评 本题考查了物质的量浓度的计算,题目难度中等,明确物质的量与物质的量浓度、摩尔质量之间的关系为解答关键,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:解答题
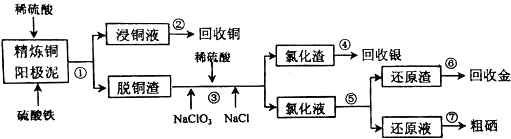
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L CCl4所含原子数目为2.5NA | |
| B. | 常温常压下,64g SO2中含有的原子数为3NA | |
| C. | 将1 mol Cl2通入水中能生成1mol HClO | |
| D. | 2L 0.1 mol•L-1K2SO4溶液中含K+物质的量为0.2 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
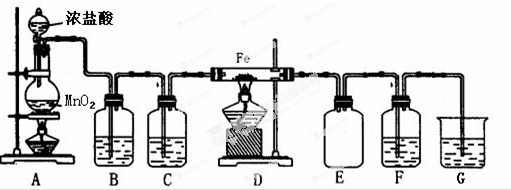
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
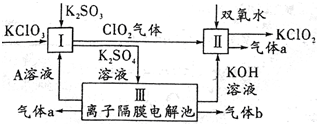 氯酸钾(KC1O3)和亚氯酸钾(KClO2)可以相互转化,KClO2在碱性环境中能稳定存在,生产KClO2的主要流程如图所示.
氯酸钾(KC1O3)和亚氯酸钾(KClO2)可以相互转化,KClO2在碱性环境中能稳定存在,生产KClO2的主要流程如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、Na+、OH- | B. | Na+、NO3-、Cl- | ||
| C. | K+、H+、HCO3- | D. | Ca2+、SO42-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Ca2+、Cl-、SO42- | B. | Fe2+、H+、AlO2-、ClO- | ||
| C. | Fe2+、Na+、Cl-、NO3- | D. | K+、Fe3+、NO3-、SCN- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com