
(12分)现用质量分数为98%、密度为1.84 g·cm-3的浓硫酸来配制500 mL、0.2 mol·L-1的稀硫酸。可供选择的仪器有:①玻璃棒 ②烧瓶 ③烧杯 ④托盘天平 ⑤量筒 ⑥药匙
请完成下列问题:
(1)上述仪器中,在配制稀硫酸时用不到的有________(填代号),
除上述仪器外,还缺少的必要仪器是
(2)经计算,需浓硫酸的体积为________,现有①10 mL ②25 mL ③50 mL ④100 mL四种规格的量筒,你选用的量筒是________(填代号)。
(3)在配制过程中,其他操作都准确,下列操作中错误的是_____ ___________,能引起误差偏高的有_____ ___(填代号)。
①洗涤量取浓硫酸后的量筒,并将洗涤液转移到容量瓶中 ②未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中 ③将浓硫酸直接倒入烧杯,再向烧杯中注入蒸馏水来稀释浓硫酸 ④定容时,加蒸馏水超过标线,又用胶头滴管吸出 ⑤转移前,容量瓶中含有少量蒸馏水 ⑥定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线 ⑦定容时,俯视标线
(12分) (1)②④⑥ 胶头滴管、500 mL容量瓶
(2)5.4 mL ① (3)①②③④⑥⑦ ①②⑦
【解析】
试题分析:(1)硫酸是液体,不需要称量,因此不需要的仪器有托盘天平和钥匙。另外在一定物质的量浓度溶液的配制时,不需要烧瓶,答案选②④⑥。配制500ml溶液,因此还需要500ml容量瓶以及定容时的胶头滴管。
(2)由于稀释过程中溶质不变,所以需要浓硫酸的体积是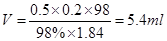 ,所以应该需要10ml量筒,答案选①。
,所以应该需要10ml量筒,答案选①。
(3)量取后量筒是不能把量筒中的洗涤液导入容量瓶中的,否则浓度偏高,①不正确;硫酸溶于水放出大量的热,所以冷却,否则浓度偏高,②不正确;稀释浓硫酸应该将浓硫酸沿着器壁注入水中,并不断搅拌,④男子气;⑥不正确,不应该再加入蒸馏水,否则浓度偏低;定容时俯视刻度线,是不正确的,应该是平视,否则浓度偏高。
考点:考查物质的量浓度溶液的配制及其误差分析等
点评:配制一定物质的量浓度溶液的实验是中学化学中一个重要的定量实验,实验过程中引起溶液浓度存在误差的因素有很多。从大的方面讲,一是由实验过程中的不规范操作引起的;二是由仪器或药品等系统原因引起的。


 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案科目:高中化学 来源: 题型:
(12分,每空2分)过氧化氢是重要的氧化剂、还原剂,它的水溶液又称为双氧水,常用作消毒、杀菌、漂白等。某化学兴趣小组取一定量的过氧化氢溶液,准确测定过氧化氢的含量。
请填写下列空白:
(1)移取10.00 mL密度为ρg/mL的过氧化氢溶液至250mL ___________(填仪器名称)中,加水衡释至刻度,摇匀。移取稀释后的过氧化氢溶液25.00mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。
(2)用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式如下,请将相关物质的化学计量数及化学式填写在方框里。
(3) 滴定时,将高锰酸钾标准溶液注入______________________(填“酸式”或“碱式”)滴定管中。滴定到达终点的现象是_________。
(4) 重复滴定三次,平均耗用cmol/L KMnO4标准溶液VmL,则原过氧化氢溶液中过氧化氢的质量分数为______________________________________。
(5) 若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果_________(填“偏高”或“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源:2012届江苏省南通市通州区高三重点热点专项检测化学试卷 题型:填空题
(12分) 明矾石的主要成分是K2SO4·Al2(SO4)3·2Al 2O3·6H2O,此外还含有少量Fe2O3杂质。利用明矾石制备氢氧化铝的流程如下: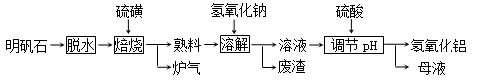
回答下列问题:
(1)“焙烧”过程中发生的反应为2Al2(SO4)3+3S  2Al 2O3+9SO2,其中氧化剂为 。
2Al 2O3+9SO2,其中氧化剂为 。
(2)“溶解”时反应的离子方程式为 。
(3)“调节pH”后过滤、洗涤Al(OH)3沉淀,证明已洗涤干净的实验操作和现象是
。
(4)调节pH时使用的是质量浓度(单位体积溶液所含溶质的质量)为882 g/L 的H2SO4 ,配制1L该溶液,需用量筒量取质量分数为98﹪的硫酸(密度是1.8g/cm3)
mL
(5)“废渣”、“母液”中可回收的物质分别是 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年江苏省、大丰高中、栟茶高中高三第二次调研联考化学试卷 题型:填空题
(12分)我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法。高炉内可能发生如下反应:
C(s)+O2(g) = CO2(g) △H1=-393.5 kJ·mol—1 ①
C(s)+CO2(g) = 2CO(g) △H2=+172.5 kJ·mol—1 ②
4CO(g)+Fe3O4(s) = 4CO2(g)+3Fe(s) △H3=-13.7 kJ·mol—1 ③
请回答下列问题:
⑴计算3Fe(s)+2O2(g) = Fe3O4(s)的△H=___________________。
⑵800℃时,C(s)+CO2(g)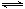 2CO(g)的平衡常数K=1.64,相同条件下测得高炉内c(CO)=0.20 mol·L-1、c(CO2)=0.05 mol·L-1,此时反应向_______(填“正”或“逆”)方向进行。
2CO(g)的平衡常数K=1.64,相同条件下测得高炉内c(CO)=0.20 mol·L-1、c(CO2)=0.05 mol·L-1,此时反应向_______(填“正”或“逆”)方向进行。
⑶某种矿石中铁元素以氧化物FemOn形式存在,现进行如下实验:将少量铁矿石样品粉碎,称取25.0 g样品于烧杯中,加入稀硫酸充分溶解,并不断加热、搅拌,滤去不溶物。向所得滤液中加入10.0 g铜粉充分反应后过滤、洗涤、干燥得剩余固体3.6 g。剩下滤液用浓度为2 mol·L-1的酸性KMnO4滴定,至终点时消耗KMnO4溶液体积25.0 mL。
提示:2Fe3++Cu=2Fe2++Cu2+ 8H++MnO4-+5Fe2+=Mn2++5Fe3++4H2O
①计算该铁矿石中铁元素的质量分数。(请写出必要的解题步骤)
②计算氧化物FemOn的化学式(m、n为正整数)(请写出必要的解题步骤)
查看答案和解析>>
科目:高中化学 来源:2011-2012年浙江省东阳市高二上学期期中考试化学(理)试卷 题型:填空题
(12分)①制备纳米TiO2的方法之一是TiCl4水解生成TiO2·xH2O,经过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2。
②用NaOH测定滤液的浓度:准确称量1.000gNaOH固体质量,配制成250mL溶液,准确量取25.00mL溶液装在碱式滴定管,滴加2滴酚酞作指示剂。把滤液装在酸式滴定管中,调节液面排除气泡后,滤液的凹液面刚好在“0”刻度,滴定NaOH溶液,达到终点记录读数。实验重复3次。记录见下表。
|
滴定次数 |
NaOH溶液体积/mL |
滴定消耗滤液体积/mL[来源: |
|
1 |
25.00 |
20.02 |
|
2 |
25.00 |
17.10 |
|
3 |
25.00 |
19.98 |
请回答下列问题:
(1)TiCl4水解生成TiO2·xH2O的化学方程式为_______________________________。
(2) 配制成250mL溶液使用的量具是 ,指示剂还可用____________;
(3) 滴定终点的现象是_______________________。
(4) 滤液中溶质的物质的量浓度为_____________。
(5) 若在滴定终点读取滴定管刻度时,俯视标准液液面,使对测定结果________。 (填“偏高”、“偏低”或“无影响”)
查看答案和解析>>
科目:高中化学 来源:2010年辽宁省沈阳四校联合体高二上学期期中考试化学卷 题型:选择题
(12分,每空2分)过氧化氢是重要的氧化剂、还原剂,它的水溶液又称为双氧水,常用作消毒、杀菌、漂白等。某化学兴趣小组取一定量的过氧化氢溶液,准确测定过氧化氢的含量。
请填写下列空白:
(1)移取10.00 mL密度为ρg/mL的过氧化氢溶液至250mL ___________(填仪器名称)中,加水衡释至刻度,摇匀。移取稀释后的过氧化氢溶液25.00mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。
(2)用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式如下,请将相关物质的化学计量数及化学式填写在方框里。

(3) 滴定时,将高锰酸钾标准溶液注入______________________(填“酸式”或“碱式”)滴定管中。滴定到达终点的现象是_________。
(4) 重复滴定三次,平均耗用cmol/L KMnO4标准溶液VmL,则原过氧化氢溶液中过氧化氢的质量分数为______________________________________。
(5) 若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果_________(填“偏高”或“偏低”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com