
【题目】奥运会篮球比赛用球男女有别。男子篮球比赛用7#球,内部空间体积大约是7.35 L,比赛时内部压强约为170 kPa。己知,在25℃,100 kPa时,气体摩尔体积约为24.5 L/mol。假设比赛场馆温度为25℃,下列说法中正确的是
A.比赛时,篮球内一般充填氮气
B.比赛时,篮球内约有空气0.3 mol
C.比赛时,篮球内约有空气14.8 g
D.当25℃,170kPa时,Vm>24.5 L/mol
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】现有A、B、C、D四种短周期元素,A分别与B、C、D结合生成甲、乙、丙三种化合物,且甲、乙、丙三分子中含相同数目的质子数,C、D结合生成化合物丁。有关元素的单质和甲、乙、丙、丁四种化合物的转化关系如下图所示:

请回答下列问题:
(1)写出B+乙―→甲+C的化学反应方程式__________________________。
(2)根据以上条件可以确定A、B、C、D四种元素中的三种,不能被确定的第四种元素是________。(填写序号)
①A ②B ③C ④D
(3)依据下列条件可以进一步确定上述第四种元素:
①甲与丙以及乙与丙均能够发生反应,②甲、丙都是无色、有刺激性气味的物质。
据此,请回答下列问题:
写出上述第四种元素在周期表中的位置________。
写出C+丙―→乙+丁的化学反应方程式_________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等体积的硫酸铝、硫酸锌、硫酸钠溶液分别与足量氯化钡溶液反应,若生成硫酸钡沉淀的质量比为2∶2∶3,则三种硫酸盐的物质的量浓度之比为
A. 1∶2∶3 B. 2∶2∶3 C. 3∶2∶2 D. 2∶6∶9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分类是学习和研究化学的一种重要方法。下列分类合理的是( )
A. K2CO3和K2O都属于盐 B. H2SO4和HNO3都属于酸
C. KOH和Na2CO3都属于碱 D. Na2O和Na2SiO3都属于氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,两个连通容器用活塞分开,左右两室体积相同,左室充入一定量NO,右室充入一定量O2,且恰好使两容器内气体密度相同。打开活塞,使NO与O2充分反应,下列判断正确的是(不考虑NO2转化为N2O4)

A.开始时左右两室中的分子数相同
B.反应前后左室的压强相同
C.反应后容器内的密度与反应前的相同
D.反应后容器内无O2存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2和甲烷催化合成CO和H2是CO2资源化利用的有效途径。主要反应为
Ⅰ:CH4(g)+CO2(g) ![]() 2CO(g)+2H2(g) △H=+247kJ/mol
2CO(g)+2H2(g) △H=+247kJ/mol
(1)已知CH4(g)+H2O(g) ![]() CO(g)+H2(g) △H=+206kJ/mol
CO(g)+H2(g) △H=+206kJ/mol
写出CH4和水蒸气反应生成CO2的热化学方程式_________。
(2)在恒温、恒容的密闭容器中发生反应I,下列选项能够说明反应I达到平衡状态的是______。
A.混合气体的密度不变
B.混合气体的总压强不变
C.CH4、CO2、CO、H2的物质的量之比为1:1:2:2
D.3V正(H2)=V逆(CH4)
E.混合气体的平均相对分子质量不变
(3)催化合成的温度通常维持在550-750℃之间,从反应速率角度分析其主要原因可能是_________。
(4)将CH4与CO2各1mol充入某密闭容器中,发生反应I。100Kpa时,反应I到达平衡时CO2的体积分数与温度的关系曲线如图所示。

①图中A、B、C三点表示不同温度、压强下达到平衡时CO2的体积分数,则______点对应的平衡常数最小,判断依据是________;__________点对应的压强最大。
②300℃,100Kpa下,该容器中反应I经过40min达到平衡,计算反应在0-40min内的平均反应速率为v(CO2)=_________mol/min(结果保留两位有效数字),该温度下的压强平衡常数Kp=________。
(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、U五种元素,均位于周期表的前四周期,它们的核电荷数依次增加,且核电荷数之和为54。X的激发态原子电子排布式为2p1,Y原子的基态原子有3个不同的能级,且各能级中电子数相等,Z的基态原子中有3个未成对电子,W的电离能如下表所示,U原子的K层电子数与最外层电子数之比为2:1,其d轨道处于全充满状态。
元素 | 第一电离能 | 第二电离能 | 第三电离能 |
W | 495.8 | 4562 | 6910.3 |
(1)U原子电子排布式为_______________。
(2)X与Z 形成的化合物Z2X4,Z原子采取的杂化轨道类型为_______,Y的最高价氧化物的水化物的正盐的阴离子的空间构型为_______;
(3)W的氯化物和Mg的氯化物中,熔点较高的是________(填化学式),原因是_______。
(4)I4O9由一种阳离子和一种阴离子按物质的量比1:3构成,阴离子的空间构型为三角锥形,中心原子杂化类型为sp3杂化,写出I4O9的电离方程式______。
(5)Nb(黑球)和I(白球)能形成一种线性的无机高分子化合物,其结构是许多八面体通过棱边而联结起来的长链,如下图所示。则该化合物中Nb和I的原子个数比为______。
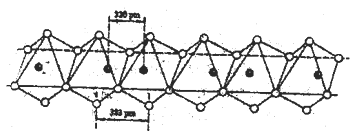
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,调节反应物用量或浓度不会改变反应产物的是( )
A. CO2通入石灰水 B. AlCl3溶液中滴入NaOH溶液
C. NaHCO3溶液中滴入稀盐酸 D. 硫酸中加入锌粉
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com