
分析 (1)①H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ/mol,
②4NH 3 (g)+5O 2 (g)?4NO(g)+6H 2O(l)△H=-1168.8kJ/mol,
③N2(g)+O 2(g)═2NO(g)△H=+180.6kJ/mol,
根据盖斯定律,①×3+③-$\frac{1}{2}$②可得N2(g)+3H2(g)═2NH 3 (g)△H;
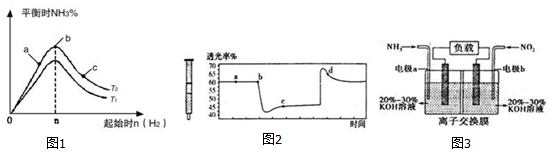
(2)①根据温度升高化学平衡向着吸热方向进行;
②根据a、b、c三点所表示的意义,结合化学平衡移动的方向进行判断;
③根据反应物的物质的量之比为等于化学计量数之比时,达平衡状态时生成物的百分含量最大;先求出各自的平衡浓度,然后根据平衡常数的概念来回答;
(3)该反应是正反应气体体积减小的放热反应,压强增大平衡虽正向移动,但二氧化氮浓度增大,混合气体颜色变深,压强减小平衡逆向移动,但二氧化氮浓度减小,混合气体颜色变浅,据图分析,b点开始是压缩注射器的过程,气体颜色变深,透光率变小,c点后的拐点是拉伸注射器的过程,气体颜色变浅,透光率增大,据此分析;
(4)由反应6NO2+8NH3═7N2+12H2O可知,反应中NO2为氧化剂,NH3为还原剂,则A为负极,B为正极,负极发生氧化反应,正极发生还原反应,结合电解质溶液呈碱性解答;
解答 解:(1)氢气的燃烧热为285.8kJ/mol,可得①H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ/mol,
②4NH 3 (g)+5O 2 (g)?4NO(g)+6H 2O(l)△H=-1168.8kJ/mol,
③N2(g)+O 2(g)═2NO(g)△H=+180.6kJ/mol,
根据盖斯定律,①×3+③-$\frac{1}{2}$②可得N2(g)+3H2(g)═2NH 3 (g)△H=(-285.8kJ/mol)×3+(+180.6kJ/mol)-$\frac{1}{2}$×(-1168.8kJ/mol)=-92.4kJ/mol,
故答案为:-92.4kJ/mol;
(2)①反应为放热反应,温度升高化学平衡向着吸热方向进行,从T1到T2反应物氮气的量增加,故T1<T2,
故答案为:高于;
②c点氢气的物质的量比ab点多,平衡向右移动,氮气的转化率增大,
故答案为:c;
③当氮气和氢气的物质的量之比为1:3时达平衡状态时氨的百分含量最大,平衡点时产物的产率最大,据图示,当平衡时氢气的物质的量为n,故加入N2的物质的量为$\frac{1}{3}$n,当n=3mol反应达到平衡时H2的转化率为60%,故起始氮气浓度为1mol/L,变化的氢气浓度为1.8mol/L,变化的氮气浓度为0.6mol/L,平衡时氮气、氢气、氨气的浓度分别是0.4mol/L、1.2mol/L、1.2mol/L,据K=$\frac{[N{H}_{3}]^{2}}{[{N}_{2}]•[{H}_{2}]^{3}}$=$\frac{1.{2}^{2}}{0.4×1.{2}^{3}}$=$\frac{25}{12}$,
故答案为:<; c;1:3;$\frac{25}{12}$;
(3)A、b点开始是压缩注射器的过程,气体颜色变深,透光率变小,故A正确;
B、c点是压缩注射器后的情况,二氧化氮和四氧化二氮的浓度都增大,故B错误;
C、b点开始是压缩注射器的过程,平衡正向移动,反应放热,导致T(b)<T(c),升温平衡逆向移动,平衡常数减小,所以Kb>Kc,故C正确;
D、c点后的拐点是拉伸注射器的过程,d点是平衡向气体体积增大的逆向移动过程,所以v(逆)>v(正),故D错误;
故答案为:AC;
(4)①由反应6NO2+8NH3═7N2+12H2O可知,反应中NO2为氧化剂,NH3为还原剂,则a为负极,b为正极,负极电极方程式为2NH3-6e-+60H-=N2+6H2O,
故答案为:负;2NH3-6e-+60H-=N2+6H2O;
②当有0.1mol NO2被处理时,转移电子为0.1mol×(4-0)=0.4mol,
故答案为:0.4;
③原电池工作时,阴离子向负极移动,为使电池持续放电,离子交换膜需选用阴离子交换膜,防止二氧化氮反应生成硝酸盐和亚硝酸盐,导致原电池不能正常工作,
故答案为:阴离子.
点评 本题主要考查的是反应热的计算、化学反应平衡移动与图象、电化学等知识,综合性较强,难度较大,注意氧化还原反应原理在电化学中的应用.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L醋酸钠溶液20ml与0.1mol/L盐酸10mL混合后的溶液中:c(CH3COO-)>c(Cl-)>c(H+)>c(CH3COOH) | |
| B. | 物质的量浓度相等的①NH4Cl②(NH4)2SO4③NH4Al(SO4)2三种溶液中,c(NH4+)由大到小的顺序为:③>②>① | |
| C. | 浓度为O.lmol/L的①氨水、②C6H5ONa溶液、③Na2CO3溶液、④NaHCO3溶液,pH的大小顺序:①>④>③>②> | |
| D. | NaHCO3溶液中:c(H+)+c(H2CO3)=c(CO32-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①③ | C. | ①④ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾净水的原理和家用消毒液消毒的原理相同,都能起到消毒杀菌作用 | |
| B. | 聚乙烯、聚氯乙烯都是高分子化合物,但聚氯乙烯薄膜不能用于包装食品 | |
| C. | “天宫一号”使用的碳纤维,是一种新型有机高分子材料 | |
| D. | 铝合金的大量使用,归功于人们能用焦炭等还原剂从氧化铝中获得铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体的压强 | B. | D的物质的量浓度 | ||
| C. | A的物质的量浓度 | D. | 气体的总物质的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 现象或事实 | 解释 |
| A | 用热的烧碱溶液洗去油污 | Na2CO3可直接和油污反应 |
| B | 漂白粉在空气中久置变质 | 漂白粉中的CaCl2与空气中的CO2反 应生成CaCO3 |
| C | 施肥时,草木灰(有效成分为K2CO3)不能 与NH4Cl混合使用 | K2CO3与NH4Cl反应生成氨气会降低 肥效 |
| D | FeCl3溶液可用于铜质印刷线路板制作 | FeCl3能从含有Cu2+的溶液中置换出铜 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,30 g乙烷气体中所含有的共价键数目为6NA | |
| B. | 标准状况下,0.4 g D2中所含中子的数目为0.2NA | |
| C. | 常温下,1 L pH=12的氨水溶液中含有NH4+数目为0.01NA | |
| D. | 标准状况下,盛有11.2 L NO2的密闭容器中氮原子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
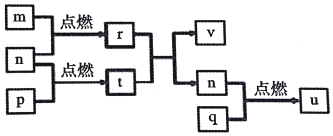 短周期主族元素X、Y、Z、W的原子序数依次增大.四种元素形成的单质依次为m、n、p、q,r、t、u是这些元素组成的二元化合物,其中u为形成酸雨的主要物质之一;25℃时,0.01mol•L-1的v溶液中:$\frac{c(O{H}^{-})}{c({H}^{+})}$=1.0×1010.上述物质的转化关系如图所示.下列说法正确的是( )
短周期主族元素X、Y、Z、W的原子序数依次增大.四种元素形成的单质依次为m、n、p、q,r、t、u是这些元素组成的二元化合物,其中u为形成酸雨的主要物质之一;25℃时,0.01mol•L-1的v溶液中:$\frac{c(O{H}^{-})}{c({H}^{+})}$=1.0×1010.上述物质的转化关系如图所示.下列说法正确的是( )| A. | 原子半径的大小:W>Z>Y>X | |
| B. | Z分别与Y、W组成的化合物中化学键类型可能相同 | |
| C. | v能抑制水的电离而u能促进水的电离 | |
| D. | 粘有q的试管可用酒精洗涤 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com