
| A. | 反应过程中,若增大压强能提高SiCl4的转化率 | |
| B. | 若反应开始时SiCl4为1 mol,则达到平衡时,吸收热量为Q kJ | |
| C. | 反应至4 min时,若HCl浓度为0.12 mol•L-1,则H2的反应速率为0.03 mol•(L•min-1) | |
| D. | 当反应吸收热量为0.025Q kJ时,生成的HCl通入100 mL 1 mol•L-1的NaOH溶液中恰好反应 |
分析 A.增大平衡向气体体积减小的方向移动,据此判断;
B.该反应为可逆反应,1molSiCl4不能完全转化,结合热化学方程式判断;
C.根据v=$\frac{△c}{△t}$计算v(HCl),利用速率之比等于化学计量数之比计算判断;
D.根据反应吸收的热量计算生成的HCl的物质的量,据此判断.
解答 解:A.因反应是气体体积增大的反应,所以加压会减小SiCl4的转化率,故A错误;
B.该反应为可逆反应,1molSiCl4不能完全转化,达平衡时,吸收热量小于QkJ,故B错误;
C.反应至4min时,若HCl浓度为0.12mol/L,则v(HCl)=$\frac{0.12mol/L}{4min}$=0.03mol/(L•min),根据反应速率之比等于化学计量数之比,则v(H2)=$\frac{1}{2}$×v(HCl)=$\frac{1}{2}$×0.03mol/(L•min)=0.015mol/(L•min),故C错误;
D.由方程式可知,当反应吸收热量为0.025QkJ时,生成HCl的物质的量为:$\frac{0.025QkJ}{QkJ/mol}$=0.1mol,100mL1mol/L的NaOH的物质的量为0.1L×1mol/L=0.1mol,二者物质的量相等,恰好反应,故D正确;
故选D.
点评 本题考查较为综合,涉及反应热的计算、化学反应速率、化学平衡等问题,题目难度中等,注意反应的可逆性,明确化学平衡及其影响因素,试题有利于提高学生的灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 混合气体的密度 | B. | 混合气体的压强 | ||
| C. | 混合气体的平均摩尔质量 | D. | SO2的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
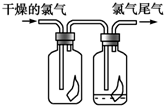 (1)如图所示,将氯气依次通过盛有干燥的有色布条和湿润的有色布条的广口瓶,可观察到的现象是干燥的有色布条无明显现象,潮湿的有色布条褪色.
(1)如图所示,将氯气依次通过盛有干燥的有色布条和湿润的有色布条的广口瓶,可观察到的现象是干燥的有色布条无明显现象,潮湿的有色布条褪色.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钡溶液与硫酸铜溶液反应:Ba2++SO${\;}_{4}^{2-}$═BaSO4↓ | |
| B. | 向10mL1mol/LNa2CO3溶液中逐滴加入5mL1mol/L盐酸:2H++CO${\;}_{3}^{2-}$═CO2↑+H2O | |
| C. | 将过量SO2通入冷氨水中:SO2+NH3•H2O═HSO${\;}_{3}^{-}$+NH${\;}_{4}^{+}$ | |
| D. | 用稀硝酸洗涤试管内壁的银镜:Ag+2H++NO${\;}_{3}^{-}$═Ag++NO↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将氯气、铁按n(Cl2):n(Fe)=5:4混合点燃:5Cl2+4Fe$\frac{\underline{\;点燃\;}}{\;}$2FeCl3+2FeCl2 | |
| B. | 将0.5molN2和1.5molH2于密闭容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为N2(g)+3H2(g)═2NH3(g)△H=-38.6kJ•mol-1 | |
| C. | 将大理石粉末置于FeCl3溶液中有气泡产生:2Fe3++3H2O+3CaCO3═2Fe(OH)3↓+3CO2↑+3Ca2+ | |
| D. | 将浓度均为0.1mol•L-1的NaOH、NH4HCO3等体积混合:NH4++OH-═NH3•H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 碳、氢、氟、氮、硅等非金属元素与人类的生产生活息息相关.回答下列问题:
碳、氢、氟、氮、硅等非金属元素与人类的生产生活息息相关.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca2+1s22s22p63s23p6 | B. | O2-1s22s22p4 | ||
| C. | Cl- 1s22s22p63s23p6 | D. | Ar1s22s22p63s23p6 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
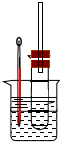 溴乙烷在不同溶剂中与NaOH发生不同类型的反应,生成不同的反应产物.某同学依据溴乙烷的性质,用如图实验装置(铁架台、酒精灯略)验证
溴乙烷在不同溶剂中与NaOH发生不同类型的反应,生成不同的反应产物.某同学依据溴乙烷的性质,用如图实验装置(铁架台、酒精灯略)验证查看答案和解析>>
科目:高中化学 来源: 题型:推断题
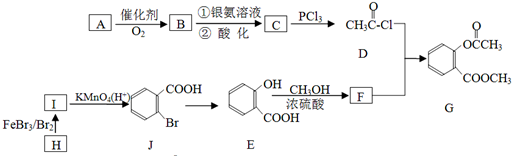
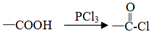
 ;
;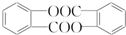 ;
;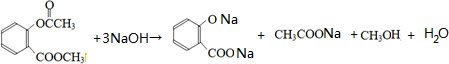 ;
;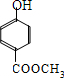 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com