
| 选项 | 实验目的 | 实验操作 |
| A | 检验蔗糖水解产物中的葡萄糖 | 取1mL 20%蔗糖溶液,加入少量稀硫酸,水浴加热后取少量溶液,加入几滴新制Cu(OH)2悬浊液,加热 |
| B | 除去乙烷中混有的少量乙烯 | 将混合气体通入足量酸性KMnO4溶液中 |
| C | 验证Mg(OH)2沉淀可以转化为Fe(OH)3沉淀 | 向2mL 1mol•L-1 NaOH溶液中加入几滴1mol•L-1 MgCl2溶液,生成白色沉淀,再加入几滴1mol•L-1 FeCl3溶液 |
| D | 硅酸胶体的制备 | 向Na2SiO3溶液(饱和溶液1:2用水稀释)中加入几滴酚酞,再逐滴滴入盐酸,边加边振荡,至溶液红色变浅并接近消失 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.蔗糖水解生成葡萄糖,检验葡萄糖应在碱性条件下进行;
B.乙烯被氧化生成二氧化碳气体;
C.氢氧化钠过量,不能比较溶度积大小;
D.Na2SiO3水解呈碱性,逐滴滴入盐酸,边加边振荡,至溶液红色变浅并接近消失,说明生成硅酸.
解答 解:A.蔗糖水解生成葡萄糖,葡萄糖与氢氧化铜浊液的反应应在碱性条件下进行,故A错误;
B.乙烯被氧化生成二氧化碳气体,引入新杂质,应用溴水除杂,故B错误;
C.验证Mg(OH)2沉淀可以转化为Fe(OH)3沉淀,应使白色沉淀转化为红褐色沉淀,氢氧化钠过量,不能证明,故C错误;
D.硅酸酸性比盐酸弱,Na2SiO3水解呈碱性,逐滴滴入盐酸,边加边振荡,至溶液红色变浅并接近消失,说明生成硅酸,可制备,故D正确.
故选D.
点评 本题考查化学实验方案的评价,涉及物质的检验、分离和制备等知识,为高考常见题型,侧重于学生的分析能力和实验能力的考查,注意把握物质的性质的异同以及实验的严密性和可行性的评价,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 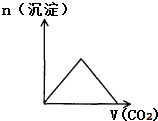 CO2通入KOH和Ca(OH)2的混合稀溶液 | B. |  CO2通入澄清石灰水中 | ||
| C. |  H2S气体通入氯水中 | D. |  NaOH溶液滴入Ba(HCO3)2溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有①②④⑤ | B. | 只有①②⑤ | C. | 只有②⑤ | D. | 只有②④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  的分子式为C7H12O 的分子式为C7H12O | |
| B. | 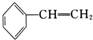 的所有原子一定在同一平面上 的所有原子一定在同一平面上 | |
| C. |  能发生还原反应、氧化反应和取代反应 能发生还原反应、氧化反应和取代反应 | |
| D. |  的二氯代物有15种 的二氯代物有15种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3个 | B. | 4个 | C. | 5个 | D. | 6个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在常温常压下,11.2升氯气含有的分子数为0.5NA | |
| B. | 在常温常压下,1摩氦气含有的原子数为2NA | |
| C. | 在常温常压下,32克氧气所含原子数目为2NA | |
| D. | 在同温同压时,相同体积的任何气体单质所含的原子数目相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 负极反应为:14H2O+7O2+28e-═28OH- | |
| B. | 放电过程中KOH的物质的量浓度不变 | |
| C. | 每消耗1molC2H6,则电路上转移的电子为14mol | |
| D. | 放电一段时间后,负极周围的pH升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com