
| A. |  反应过程中能量关系可用图表示 | |
| B. | 该反应为自发反应 | |
| C. | 若将该反应设计成原电池则锌为负极 | |
| D. | 若将其设计为原电池,当有32.5g锌溶解时,正极放出气体为11.2L |
分析 对于Zn(s)+H2SO4(aq)=ZnSO4(aq)+H2(g)△H<0,反应为放热反应,则反应物的总能量大于生成物的总能量;当将该反应设计呈原电池时,Zn为负极,被氧化,正极上析出氢气;△G=△H-T•△S<0,反应能自发进行,据此进行判断.
解答 解:A.反应为放热反应,则反应物的总能量大于生成物的总能量,图示正确,故A正确;
B.该反应是气体体积增大的反应,其熵变△S>0,又△H<0,则△H-T△S<0,所以该反应为自发反应,故B正确;
C.反应中Zn被氧化生成ZnSO4,当将该反应设计呈原电池时,Zn为负极,故C正确;
D.若将其设计为原电池,当有32.5g锌溶解时,转移电子1mol,则正极放出气体的体积在标况下为11.2L,未指明标况下就不一定为11.2 L,故D错误;
故选D.
点评 本题考查化学反应能量的变化,题目难度中等,明确反应自发进行的判断方法及原电池的工作原理为解答关键,注意掌握化学反应与能量变化的关系,试题培养了学生的灵活应用能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
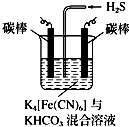 铁及其化合物在工农业生产、环境保护等领域中有着重要的作用.
铁及其化合物在工农业生产、环境保护等领域中有着重要的作用.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
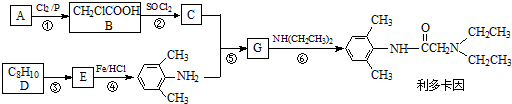
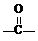 OH$\stackrel{SOCl_{2}}{→}$R
OH$\stackrel{SOCl_{2}}{→}$R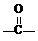 Cl
Cl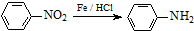
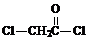 ,⑥的反应类型是取代反应.
,⑥的反应类型是取代反应. .
.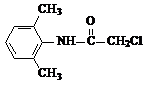 +2NaOH$\stackrel{△}{→}$
+2NaOH$\stackrel{△}{→}$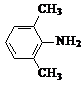 +HOCH2COONa+NaCl.
+HOCH2COONa+NaCl.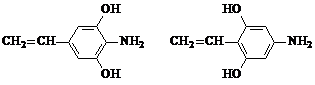 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (CH3)2CHCH(CH3)OH | B. | (CH3CH2)2CHOH | C. | CH3CH2C(CH3)2OH | D. | CH3(CH2)3CH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2O3固体可以用FeSO4溶液在蒸发皿中加热蒸干获得 | |
| B. | 可用碳酸氢铵溶液鉴别稀盐酸、氢氧化钠溶液、氯化铝溶液 | |
| C. | 用稀硝酸检验氢气还原氧化铜所生成的红色固体中含有氧化亚铜 | |
| D. | 测定相同条件下盐酸和磷酸溶液的pH,证明非金属性:Cl>P |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧元素的单质存在同素异形体 | B. | 微粒半径:O2->S2- | ||
| C. | 还原性:H2S<H2O | D. | 该反应中化学能全部转化为热能 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
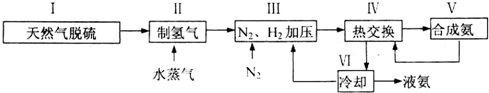
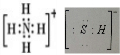 ,写出再生反应的化学方程式:2NH4HS+O2$\frac{\underline{\;一定条件\;}}{\;}$2NH3•H2O+2S;NH3的沸点高于H2S,是因为NH3分子之间存在着一种叫分子间作用的作用力.
,写出再生反应的化学方程式:2NH4HS+O2$\frac{\underline{\;一定条件\;}}{\;}$2NH3•H2O+2S;NH3的沸点高于H2S,是因为NH3分子之间存在着一种叫分子间作用的作用力.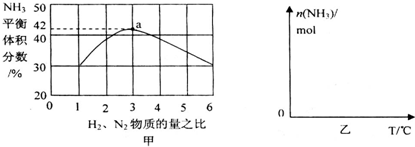
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al | B. | Al(OH)3 | C. | AlCl3 | D. | Al2O3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com