
| T/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
分析 (1)升高温度,化学平衡向吸热方向移动,根据温度化学化学平衡常数关系确定反应热;
(2)先计算浓度商,根据浓度商与化学平衡常数相对大小确定反应是否达到平衡状态;
(3)先计算浓度商,根据浓度商和化学平衡常数相对大小确定反应方向,从而确定正逆反应速率相对大小;
(4)设参加反应的c(CO2)=xmol/L,开始时c(CO2)=2mol/L、c(H2)=1mol/L,
该反应中CO2(g)+H2(g)?CO(g)+H2O(g),
开始(mol/L)2 1 0 0
反应(mol/L)x x x x
平衡(mol/L)2-x 1-x x x
化学平衡常数K=$\frac{x.x}{(2-x).(1-x)}$=1.0
x=$\frac{2}{3}$,
二氧化碳转化率=$\frac{xmol/L}{2mol/L}$×100%;
氢气转化率=$\frac{xmol/L}{1mol/L}$×100%;
若再充入1mol H2,平衡正向移动,但转化的氢气物质的量远远小于加入的氢气物质的量.
解答 解:(1)根据表中数据知,升高温度平衡常数增大,说明平衡正向移动,则正反应是吸热反应,故答案为:吸热;
(2)该反应浓度商=$\frac{0.01×0.03}{0.01×0.05}$=0.6<1.0,浓度商小于平衡常数,没有达到平衡状态,平衡正向移动,
故答案为:否;
(3)该反应浓度商=$\frac{0.01×0.03}{0.01×0.05}$=0.6<0.9,浓度商小于平衡常数,平衡正向浓度,则正反应速率大于逆反应速率,即H2O的消耗速率比生成速率小,故答案为:小;
(4)设参加反应的c(CO2)=xmol/L,开始时c(CO2)=2mol/L、c(H2)=1mol/L,
该反应中CO2(g)+H2(g)?CO(g)+H2O(g),
开始(mol/L)2 1 0 0
反应(mol/L)x x x x
平衡(mol/L)2-x 1-x x x
化学平衡常数K=$\frac{x.x}{(2-x).(1-x)}$=1.0
x=$\frac{2}{3}$,
二氧化碳转化率=$\frac{xmol/L}{2mol/L}$=$\frac{\frac{2}{3}mol/L}{2mol/L}$=$\frac{1}{3}$;
氢气转化率=$\frac{xmol/L}{1mol/L}$=$\frac{\frac{2}{3}mol/L}{1mol/L}$=$\frac{2}{3}$;
若再充入1mol H2,平衡正向移动,但转化的氢气物质的量远远小于加入的氢气物质的量,所以氢气转化率减小,
故答案为:$\frac{1}{3}$;$\frac{2}{3}$;减小.
点评 本题考查化学平衡计算,为高频考点,侧重考查学生分析计算能力,正确利用化学平衡常数与浓度商关系进行计算是解本题关键,会根据浓度商与化学平衡常数相对大小确定反应方向、正逆反应速率相对大小,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | Fe3+、Ba2+、NO3-、Cl- | B. | K+、Na+、OH-、NO3- | ||
| C. | H+、Ag+、Cl-、SO42- | D. | Cu2+、Ca2+、SO42-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图可逆反应A+2B?2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断( )
如图可逆反应A+2B?2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断( )| A. | 正反应是吸热反应 | B. | 若A、B是气体,则D是液体或固体 | ||
| C. | 改变物质浓度,平衡不会移动 | D. | A、B、C、D均为气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +99.7kJ•mol-1 | B. | +29.7kJ•mol-1 | C. | -20.6kJ•mol-1 | D. | -241.8kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Fe(SCN)3.
Fe(SCN)3.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
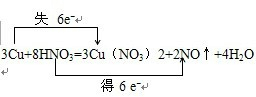 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业合成氨中,将氨气液化分离以提高氨气产率 | |
| B. | 开启啤酒瓶后,瓶中马上泛起大量泡沫 | |
| C. | 实验室中常用排饱和食盐水的方法收集氯气 | |
| D. | 两支试管中分别加入等体积5%的H3O2溶液,在其中一支试管中加入2~3滴FeCl3溶液,该试管中产生气泡快 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com