
| A. | 在自然界中只以化合态的形式存在,形成的单质是良好的半导体材料 | |
| B. | 单质常用作半导体材料和光导纤维 | |
| C. | 最高价氧化物是酸性氧化物,不能与酸反应 | |
| D. | 最高价氧化物对应的水化物的酸性比磷酸强 |
分析 某非金属元素的原子核外最外层电子数是次外层电子数的一半,最外层电子数不能超过8个,如果最外层是L层,则为Li元素,不属于非金属元素,如果最外层是M层,则为Si元素,所以该元素就是Si元素,以此解答该题.
解答 解:由以上分析可知该元素为Si.
A.Si是亲氧元素,所以在自然界中Si都以化合态存在,且硅的单质具有导电性,是良好的半导体材料,故A正确;
B.硅不能用于光导纤维,制备光导纤维的材料为二氧化硅,故B错误;
C.二氧化硅可与氢氟酸反应,故C错误;
D.非金属性Si<P,则硅酸的酸性比磷酸弱,故D错误.
故选A.
点评 本题考查原子结构与元素化合物性质,为高频考点,侧重考查学生的分析能力,难度不大,注意掌握Si元素单质化合物性质的特殊性.


科目:高中化学 来源: 题型:选择题
| A. | 分离硬脂酸和甘油 | B. | 除去乙醛中少量醋酸 | ||
| C. | 分离苯酚和苯 | D. | 除去甲烷中少量乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等于0.9mol | B. | 等于0.45mol | C. | 小于0.45 mol | D. | 大于0.45 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2O$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑ | |
| B. | 3Cl2+6NaOH $\frac{\underline{\;\;△\;\;}}{\;}$5NaCl+NaClO3+3H2O | |
| C. | 2Na2O2+2CO2═2Na2CO3+O2 | |
| D. | 2H2S+H2SO4(浓)=S↓+SO2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中和等体积、等浓度的氨水和氢氧化钠溶液至pH等于7,前者消耗的盐酸多 | |
| B. | 向NaHS 溶液中加入适量 KOH 后:c(Na+)═c(H2S)+c(HS-)+c(S2-) | |
| C. | 将amol•L-1的醋酸与0.01 mol•L-1的氢氧化钠溶液等体积混合,溶液中:c(Na+)=c(CH3COO-),醋酸的电离常数Ka=$\frac{2×1{0}^{-9}}{a-0.01}$ (用含a的代数式表示) | |
| D. | 向NH4Cl溶液中加入少量等浓度的稀盐酸,则$\frac{c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$的值减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向0.1mol/L的醋酸溶液中加大量水稀释后溶液中$\frac{{c({H^+})}}{{c(C{H_3}CO{O^-})}}$不变 | |
| B. | 向0.1mol/L的醋酸溶液中加大量水稀释后溶液中$\frac{{c({H^+})}}{{c(C{H_3}CO{O^-})}}$变小 | |
| C. | 向蒸馏水中加入Na2O,水的电离程度变小 | |
| D. | 将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3溶于水后显碱性,在FeCl3饱和溶液中通入足量NH3可制取Fe(OH)3胶体 | |
| B. | 碳酸钠溶液显碱性,用热的碳酸钠溶液可去除金属表面的油污 | |
| C. | 氢氟酸具有强酸性,可用于雕刻玻璃 | |
| D. | 铜的金属活动性比铝弱,可用铜罐代替铝罐贮运浓硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
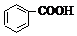 >H2CO3>
>H2CO3> >HCO3-,向Na2CO3溶液中逐滴加入水杨酸(
>HCO3-,向Na2CO3溶液中逐滴加入水杨酸( )溶液,可能发生的反应的离子方程式书写正确的是( )
)溶液,可能发生的反应的离子方程式书写正确的是( )| A. | 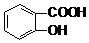 +CO32-→ +CO32-→ +HCO3- +HCO3- | B. |  +CO32-→ +CO32-→ +H2O+CO2↑ +H2O+CO2↑ | ||
| C. | 2 +CO32-→2 +CO32-→2 +CO2↑ +CO2↑ | D. | 3 +2CO32-→3 +2CO32-→3 +HCO3-+H2O+CO2↑ +HCO3-+H2O+CO2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com