
常温下,下列溶液中的粒子浓度关系正确的是
A.NH4Cl溶液中:c(Cl-)=c(NH4+) >c(OH-)=c(H+)
B.Na2SO4溶液中:c(Na+)+ c(H+)=c(SO42-) + c(OH-)
C.NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)
D.浓度均为0.1mol·L-1CH3COOH与CH3COONa溶液等体积混合:2c(H+)-2c(OH-)=c (CH3COO-)-c(CH3COOH)
D
【解析】
试题分析:A、NH4Cl溶液中,NH4+发生水解反应,溶液呈酸性,则:c(Cl-) >c(NH4+) >c(H+) >c(OH-),故A错误;B、根据溶液呈中性可得Na2SO4溶液中:c(Na+)+ c(H+)=2c(SO42-) + c(OH-),故B错误;C、HCO3?的水解程度大于电离程度,所以NaHCO3溶液中:c(Na+)>c(HCO3-)>c(OH-)>c(CO32-),故C错误;D、物质的量浓度均为0.1mol/L的CH3COONa和CH3COOH溶液等体积混合,溶液显酸性,电荷守恒为c(Na+)+c(H+)=c(CH3COO-)+c(OH-),物料守恒为c(CH3COO-)+c(CH3COOH)=0.1mol/L=2c(Na+),由上述两个式子可得2c(H+)-2c(OH-)=c (CH3COO-)-c(CH3COOH),故D正确。
考点:本题考查离子浓度比较。


 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源:2015届北京理工附中高三第一次月考化学试卷(解析版) 题型:选择题
下列四个数据是在不同条件下测出的合成氨反应的速率,其中最快的是
A.V(H2)==0.1mol/(L·min)
B.V(N2)==0.1mol/(L·min)
C.V(NH3)==0.15mol/(L·min)
D.V(N2)==0.002mol/(L·s)
查看答案和解析>>
科目:高中化学 来源:2015届北京市高三上学期第一次质量检测化学试卷(解析版) 题型:选择题
下列关于实验现象的描述不正确的是
A.把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡
B.用锌片做阳极,铁片做阴极,电解氯化锌溶液,铁片表面出现一层锌
C.把铜片插入三氯化铁溶液中,在铜片表面出现一层铁
D.把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快
查看答案和解析>>
科目:高中化学 来源:2015届北京市高三上学期第一次质量检测化学试卷(解析版) 题型:选择题
用一种试剂将NaCl、MgCl2、AlCl3、(NH4)2SO4四种无色溶液鉴别出来,该试剂是
A.Na2CO3溶液 B.AgNO3溶液
C.NaOH溶液 D.BaCl2溶液
查看答案和解析>>
科目:高中化学 来源:2015届北京市朝阳区高三年级第一学期期中统一考试化学试卷(解析版) 题型:填空题
(9分)合成氨对农业生产及国防建设均具有重要意义。
N2(g)+3H2(g)  2NH3(g) △H = -92 kJ·mol-1
2NH3(g) △H = -92 kJ·mol-1
T1℃时,在恒温恒容的密闭容器中,合成氨反应的各物质浓度变化曲线如下图所示:
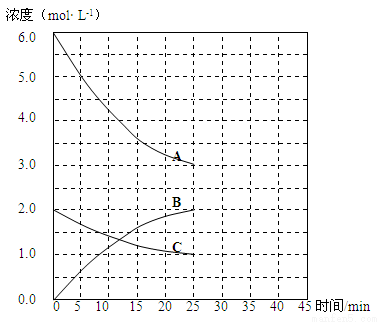
请回答:
(1)若反应起始时n(N2)为1mol、n(H2)为3mol,则反应达到平衡时,放出的热量 (填“=”或“<”或“>”)92 kJ
(2)表示N2 浓度变化的曲线是 (填浓度变化曲线代号“A”或“B”或“C”)。
(3)用H2 浓度的变化表示该反应在0~25min末的速率是 mol·L-1·min-1。
(4)若该反应在一定条件下于25 min末达到平衡状态,则
①此时平衡常数K = 。
②保持该反应条件不变至第30 min末,将温度由T1℃升高到T2℃,则反应在第40min末再次达到平衡,在此过程中H2浓度变化了1.5 mol·L-1,请在图中画出从第25 min末 ~ 45min末NH3浓度的变化曲线。
查看答案和解析>>
科目:高中化学 来源:2015届北京市朝阳区高三年级第一学期期中统一考试化学试卷(解析版) 题型:选择题
下图是模拟工业电解饱和食盐水的装置图,
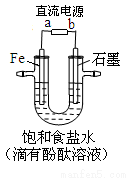
下列叙述不正确的是
A.a为电源的负极
B.Fe电极的电极反应是4OH――4e-= 2H2O+O2↑
C.通电一段时间后,铁电极附近溶液先变红
D.电解饱和食盐水的化学方程式是2NaCl + 2H2O 2NaOH + H2↑+ Cl2↑
2NaOH + H2↑+ Cl2↑
查看答案和解析>>
科目:高中化学 来源:2015届北京市朝阳区高三年级第一学期期中统一考试化学试卷(解析版) 题型:选择题
下列说法正确的是
①通过丁达尔效应可以鉴别稀豆浆和Fe(OH)3胶体
②常温时,FeCl3溶液中Fe3+与Cl-的个数之比等于1:3
③化学方程式Br2 + 2KI = 2KBr + I2说明Br的非金属性强于I
④常温时,0.1 mol·L-1 盐酸中由水电离出的c(H+)<10-7mol·L-1
A.①② B.③④ C.①③ D.②④
查看答案和解析>>
科目:高中化学 来源:2015届北京十中高三第一学期期中化学试卷(解析版) 题型:填空题
(本小题16分)高铁酸钠(Na2FeO4)是一种新型饮用水消毒剂。某研究小组设计了用工业废铁屑(含铜、碳、硅等)制取高铁酸钠的工艺流程,其中X、Y、Z是含铁化合物。
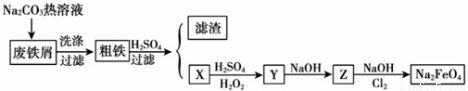
(1)废铁屑中加入碳酸钠热溶液的目的__________________________________。
(2)试写出上述过程中X转 化 为Y的离子方程式_____________________________________。
(3)写出Cl2将Z氧化为Na2Fe O 4的化学方程式________________________________。
(4)高铁酸钠消毒后的还原产物具有净水作用,解释净水原理_____________________________。
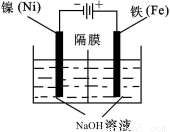
(5)电化学法制备高铁酸钠采用铁片作阳极,浓NaOH溶液作为电解质溶液(如下图所示),试写出阳极的电极反应式: ;总电解反应离子方程式为_____ 。电解一段时间后,收集到某种气体标况下为3.36L,则获得高铁酸钠的物质的量为 ,阳极区周围溶液的pH________(填“升高”、“降低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源:2015届内蒙古赤峰市宁城县高三上学期摸底统一考试化学试卷(解析版) 题型:填空题
(15分)(化学---选修物质结构与性质)Q、R、X、Y、Z五种元素的原子序数依次递增。已知:
①Z的原子序数为29,其余的均为短周期主族元素;
②Y原子价电子(外围电子)排布msnmpn
③R原子核外L层电子数为奇数;
④Q、X原子p轨道的电子数分别为2和4。
请回答下列问题:
(1)Z2+ 的核外电子排布式是 。
(2)在[Z(NH3)4]2+离子中,Z2+的空间轨道受NH3分子提供的 形成配位键。
(3)Q与Y形成的最简单气态氢化物分别为甲、乙,下列判断正确的是 。
A.稳定性:甲>乙,沸点:甲>乙 B.稳定性:甲>乙,沸点:甲<乙
C.稳定性:甲<乙,沸点:甲<乙 D.稳定性:甲<乙,沸点:甲>乙
(4)Q、R、Y三种元素的第一电离能数值由小到大的顺序为 .(用元素符号作答)
(5)Q的一种氢化物相对分子质量为26,其中分子中的σ键与π键的键数之比为 。
(6)五种元素中,电负性最大与最小的两种非金属元素形成的晶体属于 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com