
 (提示:环丁烷
(提示:环丁烷 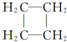 可简写成
可简写成  )
)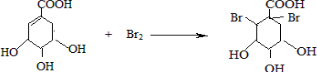
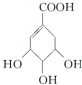
分析 (1)A含有碳碳双键,能和溴发生加成反应;
(2)计算出A的物质的量,可计算生成气体的体积;
(3)B的同分异构体中既含有酚羟基又含有酯基,则取代基为-OOCH、-OH,存在邻、间、对位置.
解答 解:(1)A与溴的四氯化碳溶液发生加成反应的化学方程式为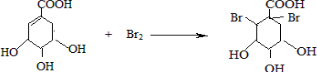 ,
,
故答案为: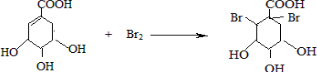 ;
;
(2)A和NaHCO3发生的反应可以表示为: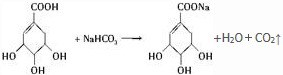 ,生成二氧化碳的体积为$\frac{17.4g}{174g/mol}$×22.4L/mol=2.24L,
,生成二氧化碳的体积为$\frac{17.4g}{174g/mol}$×22.4L/mol=2.24L,
故答案为:2.24L;
(3)B的分子式为C7H6O3,其中只能含有1个-COO-(酯基)和1个-OH(酚羟基),两者的相对位置有邻、间、对三种情况,对应物质的分别为 ,
,
故答案为:3.
点评 本题考查有机物结构和性质,为高频考点,把握官能团及其性质关系是解本题关键,难点是同分异构体种类判断,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 124 g P4含有P-P键的个数为4NA | |
| B. | 12 g石墨中含有C-C键的个数为1.5NA | |
| C. | 12 g金刚石中含有C-C键的个数为4NA | |
| D. | SiO2晶体中存在四面体结构单元,O处于中心,Si处于4个顶角 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | Fe(OH)2 | Ni(OH)2 | Co(OH)2 | Mn(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 7.5 | 7.7 | 7.6 | 8.3 | 2.7 |
| 完全沉淀pH | 9.7 | 8.4 | 8.2 | 9.8 | 3.8 |
| 难容物质 | Fe(OH)3 | Ni(OH)2 | Co(OH)2 | NiS | CoS |
| pKsp | 38.55 | 15.26 | 14.7 | 18.49 | 20.40 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②①④③⑤ | B. | ②③④①⑤ | C. | ②③⑤④① | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用酒精萃取碘水中的碘 | |
| B. | 蒸馏时,冷却水从冷凝管的上口通入,下口流出 | |
| C. | 用分液漏斗分液时,下层液体从下口放出,上层液体从上口倒出 | |
| D. | 配制1.00 mol/L NaCl溶液时,将称好的NaCl固体直接放入容量瓶中溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 葡萄糖是人体内主要供能物质,血液中葡萄糖含量过低,会使人患“低血糖”症 | |
| B. | 苯不能使溴的四氯化碳溶液褪色,说明苯分子中没有碳碳双键 | |
| C. | 分子式为C5H12的有机物只有三种,它们互为同系物 | |
| D. | 乙酸乙酯的水解反应;苯和硝酸反应生成硝基苯,两者的反应类型相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

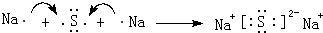 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com