
【题目】按照要求填空:
(1)![]() 在一可变的容积的密闭容器中进行
在一可变的容积的密闭容器中进行
①增加Fe的量,其反应速率的变化是______(填增大、不变、减小,以下相同)
②将容器的体积缩小一半,反应速率______________
③保持体积不变,充入N2使体系压强增大,其反应速率________
④保持压强不变,充入N2使容器的体积增大,其反应速率__________
(2)2HI(g) H2(g)+I2(g)(正反应为吸热反应)改变下列条件:
①减小容器体积:平衡____(填正移,逆移,不移动,以下相同)颜色___(加深,变浅,不变,以下相同)
②加热升高温度:平衡____________
③体积不变,充入H2:平衡_____________颜色_______________
(3)可逆反应2NO2(g) ![]() N2O4(g),(正反应为放热反应),据图判断t2、t3时刻采取的措施t2:____t3:_______
N2O4(g),(正反应为放热反应),据图判断t2、t3时刻采取的措施t2:____t3:_______

【答案】不变 增大 不变 减小 不移动 加深 正移 逆移 变浅 加入N2O4 降低温度
【解析】
增大固体反应物的量不改变反应速率;缩小容器体积,压强增大,反应速率加快;2HI(g) H2(g)+I2(g)中I2(g)有颜色,该反应为反应前后气体分子数不变的反应。
(1)①增大固体反应物的量不改变反应速率,则增加Fe的量,其反应速率不变。
②将容器的体积缩小一半,反应物浓度增大,反应速率增大。
③保持体积不变,充入不参与反应的N2,虽然体系压强增大,但反应物浓度不变,其反应速率不变。
④保持压强不变,充入不参与反应的N2,容器的体积增大,反应物浓度减小,其反应速率减小。
(2)①该反应为气体分子数不变的反应,减小容器体积,各组分浓度增大,颜色加深,但平衡不移动。
②该反应正反应为吸热反应,加热升高温度,平衡正移。
③体积不变,充入H2,增大生成物浓度,平衡逆移,I2(g)的浓度减小,颜色变浅。
(3)可逆反应2NO2(g) ![]() N2O4(g)为反应前后气体分子数减小的反应,正反应为放热反应,据图判断t2时刻正反应速率不变,逆反应速率加快,平衡逆向移动,则采取的措施为加入N2O4;t3时刻正逆反应速率都减慢,当逆反应速率大于正反应速率,平衡逆移,采取的措施为降低温度。
N2O4(g)为反应前后气体分子数减小的反应,正反应为放热反应,据图判断t2时刻正反应速率不变,逆反应速率加快,平衡逆向移动,则采取的措施为加入N2O4;t3时刻正逆反应速率都减慢,当逆反应速率大于正反应速率,平衡逆移,采取的措施为降低温度。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。
(1)T1℃时,在2L密闭容器中充入0.6molSO3,图1表示SO3物质的量随时间的变化曲线。

①平衡时,SO3的转化率为______(保留一位小数);在T1℃下反应2SO2(g)+O2(g) ![]() 2SO3(g) 的平衡常数为____________;若其他条件不变,在8min时压缩容器的体积至1L,则n(SO3)的变化曲线为_______(填字母)。
2SO3(g) 的平衡常数为____________;若其他条件不变,在8min时压缩容器的体积至1L,则n(SO3)的变化曲线为_______(填字母)。
②下表为不同温度(T)下反应2SO2(g)+O2(g) ![]() 2SO3(g) △H<0的化学平衡常数(K):
2SO3(g) △H<0的化学平衡常数(K):
T/℃ | T2 | T3 |
K | 20.5 | 4.68 |
由此推知,其他条件相同,在T1、T2、T3三种不同温度下,反应从开始至达到平衡时所需要的时间最长的是 _____________。(填“T1”、“T2”或“T3”)
(2)在体系恒压的条件下进行反应:2SO2(g)+O2(g) ![]() 2SO3(g),原料气中SO2和O2的物质的量之比(k)不同时,SO2的平衡转化率与温度(t)的关系如图2所示:图中k1、k2、k3的大小顺序为____________。
2SO3(g),原料气中SO2和O2的物质的量之比(k)不同时,SO2的平衡转化率与温度(t)的关系如图2所示:图中k1、k2、k3的大小顺序为____________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴铁氧体(CoFe2O4)不仅是重要的磁性材料、磁致伸缩材料,还是重要的锂离子电池负极材料。工业上,可以由废旧锂钴电池正极材料(主要含Fe、Al、硅等杂质)回收钴,再用电化学法制得CoFe2O4。其流程如图所示(过程中所加试剂均足量)
Ⅰ.废旧电池中钴的回收

(1)含铝滤液中,铝元素的存在形式为________(写化学式);硅在过程_____(填序号)与钴分离。
(2)写出过程②中LiCoO2与H2O2发生反应的化学方程式____________________________。
(3)过程③Na2CO3的主要作用为________________________________________。
Ⅱ.电解法制得钴铁合金
(4)配制 0.050molL-1 FeSO4和0.025molL-1 CoSO4的混合溶液,用铜作阴极、石墨作阳极进行电解,获得CoFe2合金。阴极的电极方程式为____________________________________。
Ⅲ.阳极氧化法制得钴铁氧体
(5)以1.500molL1NaOH溶液作电解液,纯净的钴铁合金(CoFe2)作阳极进行电解,在阳极上获得CoFe2O4薄膜。该电解过程的化学方程式为_________________________。
(6)当电路上有0.4mol电子转移时,阳极电极材料增重质量为3.4g,与理论值不符,其原因可能为______________________________________________。
(7)由废旧锂钴电池制CoFe2O4的现实意义在于:______________________(写一条即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
①漂白粉、水玻璃、福尔马林都是混合物
②砹(At)是第ⅦA族,AgAt易溶于水
③用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液一定是钠盐溶液
④Cs2CO3加热时不能分解为CO2和Cs2O
⑤纳米铁粉可以除被污染水体中的重金属离子
⑥根据反应SiO2+CaCO3![]() CaSiO3+CO2↑可推知硅酸酸性比碳酸强
CaSiO3+CO2↑可推知硅酸酸性比碳酸强
A.①③④⑤B.①④⑤C.③④⑤D.①③⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分是Al2O3,还有少量的Fe2O3、SiO2)提取冶炼铝的原料氧化铝。工艺流程如图,下列有关说法正确的是

A.该流程中,原料A可以是盐酸,也可以是氢氧化钠溶液
B.步骤2 中要发生的反应有:Fe3++3OH-=Fe(OH)3↓、Al3++4OH-=[Al(OH)4] -、H++OH-=H2O
C.滤液3中的主要离子有碳酸根、钠离子、氯离子
D.工业上冶炼铝用氧化铝不用氯化铝的原因是,氧化铝是电解质,氯化铝是非电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在一固定容积的密闭容器中发生反应CO2(g)+H2(g)![]() CO(g)+H2O(g),其平衡常数K和温度T的关系如下表所示:
CO(g)+H2O(g),其平衡常数K和温度T的关系如下表所示:
T/℃ | 700 | 800 | 850 | 1 000 | 1 200 |
K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
①K的表达式为__________;
②该反应的正反应为__________反应(填“吸热”或“放热”);
③下列选项中,能判断该反应已经达到化学平衡状态的是______(填字母代号)。
A.容器中压强不变
B.混合气体中CO浓度不变
C.v正(H2)=v逆(H2O)
D.c(CO2)=c(CO)
(2)下列化合物:①HCl ②NaOH ③CH3COOH ④NH3·H2O ⑤CH3COONa
⑥NH4Cl,其水溶液呈碱性的有________(填序号);常温下,0.01 mol/L HCl溶液的pH=________;pH=11的CH3COONa溶液中由水电离产生的c(OH-)=________。
(3)已知在Cu2+、Mg2+、Fe2+浓度相同的溶液中,其开始沉淀时的pH如下:
离子 | Fe2+ | Cu2+ | Mg2+ |
pH | 7.6 | 5.2 | 10.4 |
①若向该溶液中滴加NaOH溶液,则先沉淀的是__________(填离子符号);
②判断Ksp[Fe(OH)2]________Ksp[Mg(OH)2](填“>”“=”或“<”)。
(4)某电解装置如图所示。
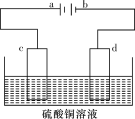
①当用惰性电极电解时,d电极的反应式为________________;
②若用此装置进行铁上镀铜,已知镀层金属采用纯铜且电镀前两电极材料质量相等,电镀一段时间后对电极进行称量,发现两极质量差为16 g,则电路中转移的电子的物质的量为________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上乙醚可用于制造无烟火药。无水乙醚微溶于水,熔点-116.3 ℃,沸点34.6 ℃,在空气中遇热易爆炸。实验室合成乙醚的原理如下:
主反应:2CH3CH2OH![]() CH3CH2OCH2CH3+H2O
CH3CH2OCH2CH3+H2O
副反应:CH3CH2OH![]() H2C=CH2↑+H2O
H2C=CH2↑+H2O
(乙醚制备)装置设计如图所示(部分装置略):
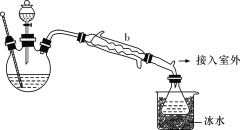
(1)仪器b应更换为下列中的________(填字母代号)。
A.干燥器
B.直形冷凝管
C.玻璃管
D.安全瓶
(2)实验操作的正确排序为________(填字母代号),取出乙醚立即密闭保存。
a.安装实验仪器 b.加入12 mL浓硫酸和少量乙醇的混合物
c.检查装置气密性 d.熄灭酒精灯
e.通冷却水并加热烧瓶 f.拆除装置
g.控制滴加乙醇速率与馏出液速率相等
(3)反应温度不超过145 ℃,其目的是____________________。
(乙醚提纯)
![]()
(4)操作a的名称是__________;进行该操作时,必须用水浴加热代替酒精灯加热,其目的与制备实验中将尾接管支管通入室外相同,均为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食品防腐剂R的结构简式如下图所示,下列说法正确的是( )
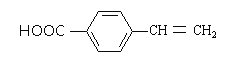
A.与CH3CH218OH发生酯化反应,生成H218O
B.与Na、NaOH、Na2CO3、NaHCO3溶液均反应
C.能使酸性高锰酸钾及溴水褪色,反应原理相同
D.1 mol化合物X最多能与5 mol H2发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是部分短周期元素原子序数与主要化合价的关系图,X、Y、Z、W、R是其中的五种元素。下列说法不正确的是

A.离子半径:Y>X
B.33号砷元素与Q同族
C.最高价氧化物的水化物的酸性:R>W
D.单质与水(或酸)反应的剧烈程度:Y>Z
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com