
【题目】有A、B、C、D、E五种短周期元素,它们的原子序数依次增大。已知A和C、B和D分别位于同主族,且B、D质子数之和是A、C质子数之和的2倍;![]() 在同周期元素中原子半径最小。
在同周期元素中原子半径最小。
(1)B形成的双原子分子中,共价键的类型有__,化合物A2B中B原子采取__杂化。
(2)A2B和A2D的沸点较高者是__(填化学式),其原因是_。
(3)E原子的电子排布式为__。
(4)写出均由A、B、C、D四种元素组成的两物质的浓溶液发生反应的离子方程式:__。
【答案】σ键、π键 sp3 H2O 水分子间能形成氢键,使其沸点高于H2S 1s22s22p63s23p5(或[Ne]3s23p5) H++HSO3-=H2O+SO2↑
【解析】
有A、B、C、D、E五种短周期元素,它们的原子序数依次增大,A和C、B和D分别位于同主族,且B、D质子数之和是A、C质子数之和的2倍,则A是H元素,C是Na元素,因此B是O元素,D是S元素,E在同周期元素中原子半径最小,且为主族的短周期元素,所以E是Cl元素,据此分析解答。
依据上述分析可知:A为氢,B为氧,C为钠,D为硫,E为氯。
(1)O形成的双原子分子是氧气,氧气分子的结构式为O=O,从轨道重叠的角度来看共价键的类型有头对头的σ键和肩并肩的π键;化合物A2B为H2O,H2O中O原子的价层电子对个数=2+![]() =4,含有2个孤电子对,所以H2O的VSEPR模型为四面体,分子空间构型为V型,中心原子杂化方式为sp3,故答案为:σ键和π键;sp3;
=4,含有2个孤电子对,所以H2O的VSEPR模型为四面体,分子空间构型为V型,中心原子杂化方式为sp3,故答案为:σ键和π键;sp3;
(2)H2O分子间存在氢键而H2S分子间不存在氢键,故H2O的沸点比H2S高,故答案为:H2O;水分子间能形成氢键,使其沸点高于H2S;
(3)E是Cl元素,其原子核外有17个电子,根据构造原理知,Cl原子的电子排布式为1s22s22p63s23p5,故答案为:1s22s22p63s23p5 ;
(4)由H、O、Na、S四种元素组成的两物质分别为:硫酸氢钠和亚硫酸氢钠,它们的浓溶液发生反应的离子方程式:H++HSO3-=H2O+SO2↑,故答案为:H++HSO3-=H2O+SO2↑。


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:
【题目】常温下,向1L 0.1mol·L1一元酸HR溶液中逐渐通入氨气(已知常温下NH3·H2O电离平衡常数K=1.76×10-5),使溶液温度和体积保持不变,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述正确的是
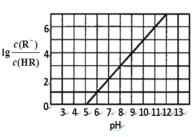
A.当c(R-)=c(HR)时,溶液必为中性
B.0.1mol·L-1HR溶液的pH为5
C.HR为弱酸,常温时随着氨气的通入,![]() 逐渐增大
逐渐增大
D.当通入0.1 mol NH3时,c(NH4+)>c(R-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢是重要而洁净的能源。要利用氢气作为能源,必须解决好储存氢气的问题。化学家研究出利用合金储存氢气的方法,其中镧(La)镍(Ni)合金是一种储氢材料,这种合金的晶体结构已经测定,其基本结构单元如图所示,则该合金的化学式可表示为( )
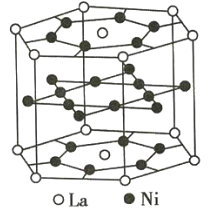
A.LaNi5B.LaNiC.La14Ni24D.La7Ni12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据杂化轨道理论和价电子对互斥理论模型判断,下列分子或离子的中心原子杂化方式及空间构型正确的是( )
选项 | 分子或离子 | 中心原子杂化方式 | 价电子对互斥理论模型 | 分子或离子的空间构型 |
A | H2O | sp1 | 直线形 | 直线形 |
B | BBr3 | sp2 | 平面三角形 | 三角锥形 |
C | PCl3 | sp2 | 四面体形 | 平面三角形 |
D | CO32- | sp2 | 平面三角形 | 平面三角形 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增大,W、X原子的最外层电子数之比为4∶3,Z原子的核外电子数比X原子多4。下列说法正确的是( )
A.W、Y、Z的电负性大小顺序一定是Z>Y>W
B.Z的氢化物分子间存在氢键
C.Y、Z形成的化合物分子的中心原子可能采取sp3杂化
D.WY2分子中σ键与π键的数目之比一定是2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关晶体的结构如图所示,下列说法中不正确的是
A.  在NaCl晶体中,距Na+最近的Cl-形成正八面体
在NaCl晶体中,距Na+最近的Cl-形成正八面体
B.  在CaF2晶体中,每个晶胞平均占有4个Ca2+
在CaF2晶体中,每个晶胞平均占有4个Ca2+
C.  在金刚石晶体中,碳原子与碳碳键数目比为1∶2
在金刚石晶体中,碳原子与碳碳键数目比为1∶2
D.  由E原子和F原子构成的气态团簇分子的分子式为EF或FE
由E原子和F原子构成的气态团簇分子的分子式为EF或FE
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原子晶体的空间结构中的一部分如图所示。该原子晶体与某物质B反应生成C,其实质是在每个A—A键中插入一个B原子,则C的化学式为( )
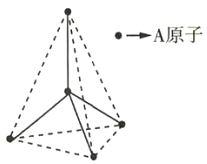
A.ABB.A5B4C.AB2D.A2B5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质发生变化时,所克服的粒子间作用力属于同种类型的是( )
A.碘与干冰受热变为气体
B.硝酸铵与硝酸受热分解变为气体
C.氯化钠与氯化氢溶解在水中
D.晶体钠熔化与冰融化
查看答案和解析>>
科目:高中化学 来源: 题型:
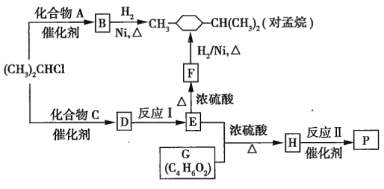
【题目】优良的有机溶剂对孟烷、耐热型特种高分子功能材料![]() 的合成路线如图所示:
的合成路线如图所示:
已知芳香化合物苯环上的氢原子可被卤代烷中的烷基取代,如:![]() (
(![]() 为烷基,
为烷基,![]() 为卤素原子)。
为卤素原子)。
(1)已知B为芳香烃。
①由B生成对孟烷的反应类型是__________________。
②![]() 与A反应生成B的化学方程式是_________________。
与A反应生成B的化学方程式是_________________。
③![]() 的同系物中相对分子质量最小的物质是_________________________。
的同系物中相对分子质量最小的物质是_________________________。
(2)已知![]() 的分子式为
的分子式为![]() 且含有一个酚羟基,且苯环上的另一个取代基与酚羟基处于间位;
且含有一个酚羟基,且苯环上的另一个取代基与酚羟基处于间位;![]() 不能使
不能使![]() 的
的![]() 溶液褪色。
溶液褪色。
①F中含有的官能团名称是_____________________。
②C的结构简式是________________。
③反应I的化学方程式是________________。
(3)G的核磁共振氢谱有3个峰,其峰面积之比为![]() ,且G与
,且G与![]() 溶液反应放出
溶液反应放出![]() 。写出反应Ⅱ的化学方程式:_________________________________。
。写出反应Ⅱ的化学方程式:_________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com