
 下表是元素周期表一部分,表中所列字母分别代表某一化学元素.
下表是元素周期表一部分,表中所列字母分别代表某一化学元素.| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 1 | a | ||||||
| 2 | b | c | d | e | f | ||
| 3 | g | h |
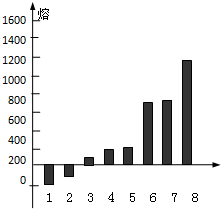
| 代表符号 | b | c | d | e | f |
| 氢化物 沸点(℃) | 1317 | -161.5 | -33.33 | 100 | 19.51 |
 ;元素的非金属性越强,对应单质的氧化性越强,则氢化物的还原性越弱,还原性:H2O>HF;
;元素的非金属性越强,对应单质的氧化性越强,则氢化物的还原性越弱,还原性:H2O>HF; ;弱;
;弱;

 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案科目:高中化学 来源: 题型:
| A、PbO2是电池的负极 |
| B、负极的电极反应式为:Pb+SO42--2e -=PbSO4↓ |
| C、PbO2得电子,被氧化 |
| D、电池放电时,溶液酸性增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
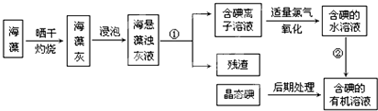
| 操作步骤 | 实验现象 |
| 取1g纯净的NaCl,加3mL水配成溶液. | 溶液无变化 |
| 滴入5滴淀粉溶液和1mL 0.1mol/L KI溶液,振荡. | 溶液无变化 |
| 然后再滴入1滴1mol/L的H2SO4,振荡. | 溶液变蓝色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
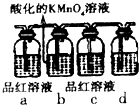 掌握物质之间的转化,是学习元素化合物知识的基础.
掌握物质之间的转化,是学习元素化合物知识的基础.查看答案和解析>>
科目:高中化学 来源: 题型:
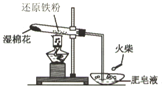 为探究铁和铁的化合物的一些化学性质,某学生实验小组设计了以下实验.
为探究铁和铁的化合物的一些化学性质,某学生实验小组设计了以下实验.| HCl |
| 足量Fe粉 |
| NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2CO3、NaHCO3两种盐溶液中,离子种类不相同 |
| B、常温下,1mol/L的CH3COOH溶液与1mol/L的NaOH溶液等体积混合,所得混合液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| C、物质的量浓度相同的NH4Cl和NH4HSO4两种溶液中,c(NH4+)前者小于后者 |
| D、常温下,某溶液中有水电离出的c(H+)=10-51mol?L-1,则此溶液可能是盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:

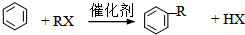
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com