
 已知A、B、C、D、E、F都是元素周期表中前四周期的元素,它们的核电荷数位次递增.B原子的p轨道半充满,形成氢化物的沸点是同主族元素的氢化物中最低的是.D原子得到一个电子后3p轨道全充满.A+比D原子形成的离子少一个电子层.C与A形成A2C型离子 化合物.E的原子序数为31,F与B属同一主族,E与F形成的化合物常用于制造半导体. 请根据以上信息,回答下列问题:
已知A、B、C、D、E、F都是元素周期表中前四周期的元素,它们的核电荷数位次递增.B原子的p轨道半充满,形成氢化物的沸点是同主族元素的氢化物中最低的是.D原子得到一个电子后3p轨道全充满.A+比D原子形成的离子少一个电子层.C与A形成A2C型离子 化合物.E的原子序数为31,F与B属同一主族,E与F形成的化合物常用于制造半导体. 请根据以上信息,回答下列问题:分析 A、B、C、D、E、F都是元素周期表中前四周期的元素,它们的核电荷数位次递增.B原子的p轨道半充满,外围电子排布式应为nS2nP3,形成的氢化物的沸点是同主族元素的氢化物中最低的,由于氨气分子之间存在氢键,沸点高于同主族其它气态氢化物,则B为P元素;D原子得到一个电子后3p轨道全充满,原子的电子排布式应为1S22S22P63S23P5,故D为Cl元素;A+比D原子形成的离子少一个电子层,则A为Na元素;C与A形成A2C型离子化合物,则C为第ⅥA主族元素,根据核电荷数可知C为S元素;E的原子序数为31,则E为Ga;F与B属同一主族,F的原子序数大于E,则F为As.
解答 解:A、B、C、D、E、F都是元素周期表中前四周期的元素,它们的核电荷数位次递增.B原子的p轨道半充满,外围电子排布式应为nS2nP3,形成的氢化物的沸点是同主族元素的氢化物中最低的,由于氨气分子之间存在氢键,沸点高于同主族其它气态氢化物,则B为P元素;D原子得到一个电子后3p轨道全充满,原子的电子排布式应为1S22S22P63S23P5,故D为Cl元素;A+比D原子形成的离子少一个电子层,则A为Na元素;C与A形成A2C型离子化合物,则C为第ⅥA主族元素,根据核电荷数可知C为S元素;E的原子序数为31,则E为Ga;F与B属同一主族,F的原子序数大于E,则F为As.
(1)同一周期元素的第一电离能从左到右呈增大趋势,P元素原子3p能级容纳3个电子,为半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能的顺序为:S<P<Cl,
故答案为:S<P<Cl;
(2)比D的原子序数大7的Q的原子核外电子数为24,电子排布式为:1s22s22p63s23p63d54s1,
故答案为:1s22s22p63s23p63d54s1;
(3)PCl3中P形成3个键,孤电子对数为$\frac{5-1×3}{2}$=1,价层电子对数为4,所以分子的空间构型是平三角锥形,
故答案为:三角锥形;
(4)①该晶胞中所包含的F原子个数为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,故答案为:4;
②与同一个E原子相连的F原子构成的空间构型为正四面体,故答案为:正四面体;
③a.E为Ga、F为As,二者均处于第四周期,故a正确;
b.NaCl晶胞中离子配位数为6,该晶胞结构与NaCl不同,故b错误;
c.同周期自左而右电负性增大,故电负性:F>E,故c正确;
d.EF晶体晶胞中E、F原子数目均为4,原子配位数均为,即Al与4个As形成共价键,含有1个配位键,故d正确.
故选:acd;
④(CH3)3Ga中Ga原子含有形成3个键,没有孤对电子,杂化轨道数目为3,杂化方式为sp2杂化,
故答案为:sp2杂化.
点评 本题是对物质结构的考查,涉及核外电子排布、电离能、电负性、空间构型与杂化方式、晶胞计算等,推断元素的种类是解答本题的关键,需要学生具备扎实的基础,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 碳酸氢铵溶液与过量的氢氧化钠溶液反应:NH4++OH-=NH3•H2O | |
| B. | 氢氧化铝与足量盐酸反应:Al(OH)3+3H+=Al3++3H2O | |
| C. | 二氧化硫和规律氢氧化钠溶液:SO2+OH-=HSO3- | |
| D. | 铜片与稀硝酸反应:Cu+NO3-+4H+=Cu2++NO↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯与氯气加成(1,2-二氯乙烷) | |
| B. | 乙烯与水加成(乙醇) | |
| C. | 等物质的量的氯气与乙烷在光照条件下反应(一氯乙烷) | |
| D. | 液溴与苯用溴化铁作催化剂反应(溴苯) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ⑥⑧ | C. | ②⑤ | D. | ③④⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 水合肼(N2H4•H2O)为无色透明的油状液体,沸点为118.5℃,熔点为-40℃.具有强碱性,在空气中可吸收CO2,产生烟雾.水合肼是一种强还原剂,能与卤素单质、HNO3、KMnO4等激烈反应.水合肼可用含NaOH的NaClO溶液氧化尿索[CO(NH2)2]溶液制得.实验室模拟水合肼的制备装置如图所示(夹持及加热装置已省略).请回答下列问题:
水合肼(N2H4•H2O)为无色透明的油状液体,沸点为118.5℃,熔点为-40℃.具有强碱性,在空气中可吸收CO2,产生烟雾.水合肼是一种强还原剂,能与卤素单质、HNO3、KMnO4等激烈反应.水合肼可用含NaOH的NaClO溶液氧化尿索[CO(NH2)2]溶液制得.实验室模拟水合肼的制备装置如图所示(夹持及加热装置已省略).请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
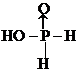 .H3PO2是一元(填“一”、“二”或“三”)酸.
.H3PO2是一元(填“一”、“二”或“三”)酸.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 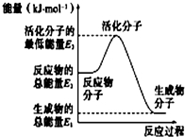 反应②中的能量变化如图所示,则△H2=E1-E3 | |
| B. | H2的燃烧热为241.8 kJ•mol-1 | |
| C. | 由反应②知在温度一定的条件下,在一恒容密闭容器中通入1 mol N2和3 mol H2,反应后放出的热量为Q1 kJ,若通入2 mol N2和6 mol H2反应后放出的热量为Q2 kJ,则184.8>Q2>2Q1 | |
| D. | 氨的催化氧化反应为4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=+906 kJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com