
【题目】某2.0L硫酸溶液中含有1.0mol H2SO4 . 向上述溶液中加入足量铁粉,试回答下列问题:
(1)写出该反应的离子方程式;
(2)溶液中H2SO4的物质的量浓度;
(3)产生气体的体积(标准状况);
(4)假设反应前后溶液体积不变,则所得溶液中Fe2+的物质的量浓度为 .
【答案】
(1)Fe+2H+═Fe2++H2↑
(2)0.5mol/L
(3)22.4L
(4)0.5mol/L
【解析】解:(1)铁与硫酸反应生成硫酸亚铁和氢气,离子方程式为:Fe+2H+═Fe2++H2↑,所以答案是:Fe+2H+═Fe2++H2↑;(2)c(H2SO4)= ![]() =0.5mol/L,所以答案是:0.5mol/L;(3)根据反应的方程式列式计算:
=0.5mol/L,所以答案是:0.5mol/L;(3)根据反应的方程式列式计算:
Fe+ | H2SO4 | = | FeSO4+ | H2↑ |
1mol | 22.4 L | |||
1.0 mol | V(H2) |
V(H2)= ![]() =22.4L,
=22.4L,
所以答案是:22.4L;(4)n(Fe2+)=n(SO42﹣)=1.0 mol
c(Fe2+)= ![]() L=0.5 mol/L
L=0.5 mol/L
所以答案是:0.5 mol/L.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】水是一种廉价而且非常有用的试剂,下列用水就能鉴别的一组物质是( )
A. 苯、溴苯、四氯化碳 B. 苯、乙醇、四氯化碳
C. 硝基苯、乙醇、四氯化碳 D. 硝基苯、乙醇、乙酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下面各物质之间的转化关系,回答问题:
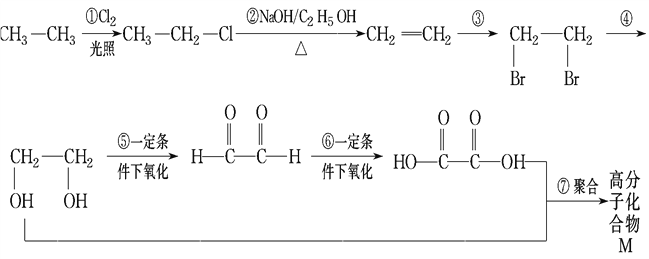
(1)属于取代反应的是___________。
(2)属于加成反应的是___________。
(3)写出反应③、④的化学方程式(有机物用结构简式表示,注明反应条件,下同)
a.反应③___________________________________________________________。
b.反应④__________________________________________________________。
c.写出![]() 和新制氢氧化铜悬浊液(NaOH碱性环境)反应的化学方程式 ____________。
和新制氢氧化铜悬浊液(NaOH碱性环境)反应的化学方程式 ____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:4NH3+5O2 ![]() 4NO+6H2O
4NO+6H2O
(1)该反应中氧化剂是(填化学名称),被氧化的元素是(填元素符号),氧化产物是(填化学式).
(2)若有1mol O2参加反应,则转移的电子是mol.
(3)用单线桥标出该反应的电子转移方向和数目 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以软锰矿(主要成分为MnO2)和硫锰矿(主要成分为MnS)为原料(已知两种原料中均不含有单质杂质)制备高纯度硫酸锰的工艺流程如图所示。
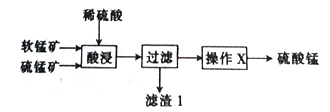
(1)已知滤渣1中含有一种非金属单质,该非金属单质的化学式为_____________________。
(2)已知二氧化锰与硫化锰的物质的量之比对酸浸时的浸出率有影响,相关实验数据如下表所示。当二氧化锰与硫化锰的物质的量之比为______________时,为最优反应配比。
号 | 二氧化锰与硫化锰的物质的量之比 | 浸出液的pH | 浸出率% |
1 | 1.25:1 | 2.5 | 95.30 |
2 | 1.75:1 | 2.5 | 97.11 |
3 | 2.25:1 | 2.5 | 99.00 |
4 | 2.5:1 | 2.5 | 98.40 |
(3)操作X为蒸发浓缩、______________、过滤,洗涤、烘干,在洗涤操作中,常用酒精洗涤MnSO4·H2O晶体,其主要目的是_________。
(4)现有10t锰矿,其中MnO2和MnS的含量均为29%,若流程中Mn的损耗率为10%,则最终制得硫酸锰(MnSO4·H2O)_________t。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是
A. Fe(OH)3和HI的反应 Fe(OH)3+3H+==Fe3++3H2O
B. 1.5 mol/L 100 ml的FeBr2溶液中通入3.36L(标准状况)Cl2:2Fe2++2Br-+2Cl2==2Fe3++4Cl-+Br2
C. 铁与足量的稀硝酸溶液反应放出NO气体:3Fe+8H++2NO3-==3Fe2++4H2O+2NO↑
D. 向明矾[KAl(SO4)2]溶液中逐滴加入Ba(OH)2溶液至SO42-恰好沉淀完全:2Al3++3SO42-+3Ba2++6OH-==2Al(OH)3↓+3BaSO4↓
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com