
分析 (1)根据c=$\frac{1000ρω}{M}$计算公式变形计算NaOH的质量分数;
(2)氢气与氯气反应,用NaOH吸收气体,所得的溶液中含有NaClO,故氢气与氯气反应时,氯气有剩余,用氢氧化钠吸收后溶液中溶质为NaCl、NaClO,根据c=nV计算NaOH物质的量,根据钠离子守恒,溶液中n(NaOH)=n(NaCl)+n(NaClO),据此计算溶液中n(NaCl),溶液中n(Cl-)=n(NaCl);
(3)根据氯原子守恒有2n(Cl2)=n(NaCl)+n(NaClO)=n(NaOH),根据电子转移守恒计算氯气与氢氧化钠反应生成NaCl,进而计算HCl与氢氧化钠反应生成的NaCl,再根据H原子守恒计算n(H2),据此解答.
解答 解:(1)根据c=$\frac{1000ρω}{M}$可知,NaOH溶液的质量分数为$\frac{3×40}{1000×1.12}$=10.7%,
故答案为:10.7%;
(2)氢气与氯气反应,用NaOH吸收气体,所得的溶液中含有NaClO,故氢气与氯气反应时,氯气有剩余,用氢氧化钠吸收后溶液中溶质为NaCl、NaClO,溶液中n(NaOH)=n(NaCl)+n(NaClO)=0.5L×0.6mol/L=0.3mol,故溶液中n(NaCl)=0.3mol-0.05mol=0.25mol,溶液中n(Cl-)=n(NaCl)=0.25mol,
故答案为:0.25;
(3)故HCl与NaOH反应生成的NaCl的物质的量为0.25mol-0.05mol=0.2mol,故n(HCl)=0.2mol,故n(H2)=$\frac{0.2mol}{2}$=0.1mol,氯原子守恒有2n(Cl2)=n(NaCl)+n(NaClO),故2n(Cl2)=n(NaOH)=0.3mol,所以n(Cl2)=0.15mol,故所用氯气和参加反应的氢气的物质的量之比n(Cl2):n(H2)=0.15mol:0.1mol=3:2,
故答案为:3:2.
点评 本题考查混合物的有关计算、溶液浓度有关计算,难度中等,清楚发生的反应是关键,注意利用守恒法进行计算,可以简化计算,侧重于考查学生的分析能力和计算能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 元素X:它的原子中M层比L层少2个电子 | |
| B. | 元素Z:位于元素周期表中的第三周期第ⅢA 族 | |
| C. | 元素Y:它的二价阳离子核外电子总数与氩原子相同 | |
| D. | 元素W:它的焰色反应颜色呈紫色 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
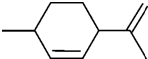
| A. | 属于芳香烃,分子式为C10H16 | B. | 常温下呈液态,比水轻 | ||
| C. | 其一氯代物有8种(不考虑顺反异构) | D. | 能与溴水发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
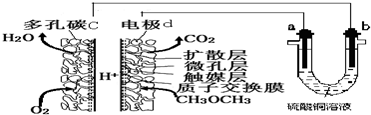
| A. | 多孔碳c能增大气固接触面积,提高反应速率,该电极为负极 | |
| B. | 燃料电池工作时,电极d上发生的反应为:CH3OCH3+12e-+3H2O═2CO2+12H+ | |
| C. | 二甲醚直接燃料电池能量密度( kW•h•kg-1)约为甲醇CH3OH)直接燃料电池能量密度的1.4倍 | |
| D. | a极是纯铜,b极是粗铜时,a极上有铜析出,b极逐渐溶解,两极质量变化相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2:1 | B. | 1:2 | C. | 1:3 | D. | 3:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含金属元素的离子不一定是阳离子 | |
| B. | 一种元素可形成多种离子,但只能是带同种电荷的离子 | |
| C. | 由同种元素组成的物质肯定属于纯净物 | |
| D. | 具有相同质子数的粒子都属于同种元素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com