
【题目】早在2000多年前,人们发现柳树皮中含有一种具有解热镇痛功效的物质—水杨酸,此后科学家对水杨酸的结构进行一系列改造,合成出疗效更佳的长效缓释阿司匹林,其开发过程蕴含着重要的思想方法,请回答下列问题:
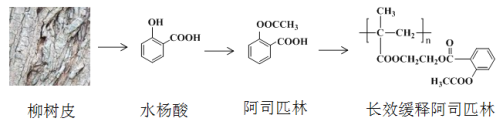
(1)水杨酸的结构与性质
①水杨酸中含氧官能团的名称是____________、______________。
②下列关于水杨酸的说法正确的是__________。
A.分子式为C7H7O3
B.1 mol水杨酸能与2 molNaOH反应
C.可发生加成、取代、消去反应
(2)水杨酸的合成
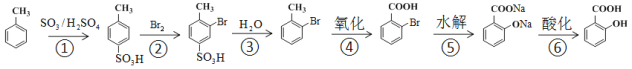
①由![]() 制
制![]() ,不采取甲苯直接与Br2直接反应,而是经过步骤①~③,目的是_______________
,不采取甲苯直接与Br2直接反应,而是经过步骤①~③,目的是_______________
②步骤④~⑥的顺序能够改为水解、酸化、氧化?____________(填“能”或“不能”),理由是__________________________________
(3)水杨酸具有解热镇痛的功效,但是其酸性很强,对人的肠胃有刺激性,容易引发胃溃疡,1897年德国化学家菲利克斯·霍夫曼对水杨酸的结构进行改造合成出阿司匹林。
①水杨酸的酸性主要来源于-COOH,将-OH转化为-OOCCH3,可使-COOH的酸性大大降低。科学家的这一设计思路依据的原理是_________________________________________
②水杨酸到阿司匹林的反应类型是_________
(4)1982年拜尔公司将阿司匹林与聚甲基丙烯酸借助乙二醇嫁接起来,研制出长效缓释阿司匹林,可减少每天吃药次数,大大方便了人们对药物的使用。
①长效缓释阿司匹林在人体内释放出阿司匹林的反应类型是______________
②写出乙烯经2步合成乙二醇的化学方程式_______________________、________________
【答案】羟基 羧基 B 防止生成![]() 副产物 不能 酚羟基也容易被氧化 官能团之间的相互影响 取代反应 水解反应
副产物 不能 酚羟基也容易被氧化 官能团之间的相互影响 取代反应 水解反应 ![]()
![]()
【解析】
(1)①水杨酸的结构简式为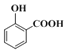 ,含有酚羟基和羧基二种官能团;
,含有酚羟基和羧基二种官能团;
②酚羟基和羧基均能和NaOH反应,能发生取代反应,苯环可发生加成反应;
(2)①有机反应副反应多,防止![]() 的生成;
的生成;
②酚羟基还原性强,易被氧化;
(3)①不同的官能团之间性质可能相互影响;
②由 可知酚羟基转化为酯基;
可知酚羟基转化为酯基;
(4)①长效缓释阿司匹林的分子结构为 ,是高分子化合物,通过降解生成阿司匹林;
,是高分子化合物,通过降解生成阿司匹林;
②乙烯先与溴水发生加成,再在NaOH的溶液中水解即可生成乙二醇。
(1)①水杨酸的结构简式为 ,含氧官能团的名称是酚羟基、羧基;
,含氧官能团的名称是酚羟基、羧基;
②A. 水杨酸的结构简式为 ,其分子式为C7H6O3,故A错误;B. 酚羟基和羧基均能和NaOH反应,则1mol水杨酸能与2molNaOH反应,故B正确;C. 水杨酸的结构简式为
,其分子式为C7H6O3,故A错误;B. 酚羟基和羧基均能和NaOH反应,则1mol水杨酸能与2molNaOH反应,故B正确;C. 水杨酸的结构简式为 ,其中苯环可发生加成反应,酚羟基和羧基可发生取代反应,但此有机物不能发生消去反应,故C错误;故答案为B;
,其中苯环可发生加成反应,酚羟基和羧基可发生取代反应,但此有机物不能发生消去反应,故C错误;故答案为B;
(2)①![]() 在Fe粉催化作用下与Br2发生取代反应,除生成
在Fe粉催化作用下与Br2发生取代反应,除生成![]() 外,还有
外,还有![]() 副产物生成,则由
副产物生成,则由![]() 制
制![]() ,经过步骤①~③,不采取甲苯直接与Br2直接反应,可防止生成
,经过步骤①~③,不采取甲苯直接与Br2直接反应,可防止生成![]() 副产物;
副产物;
②因酚羟基易被氧化,如果先水解、再酸化、氧化,则将甲基氧化为羧基时,也能氧化酚羟基,故不能将步骤④~⑥的顺序能够改为水解、酸化、氧化;
(3)①因官能团之间的相互影响,因此将水杨酸分子内的-OH转化为-OOCCH3,可能会使-COOH的酸性大大降低;
②由 可知水杨酸与乙酸发生酯化反应生成阿司匹林,其反应类型为取代反应;
可知水杨酸与乙酸发生酯化反应生成阿司匹林,其反应类型为取代反应;
(4)①长效缓释阿司匹林的分子结构为 ,则长效缓释阿司匹林在人体内释放出阿司匹林的反应类型是水解反应;
,则长效缓释阿司匹林在人体内释放出阿司匹林的反应类型是水解反应;
②乙烯先与溴水发生加成,再在NaOH的溶液中水解即可生成乙二醇,则合成乙二醇涉及的化学方程式为![]() 、
、![]() 。
。


 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案科目:高中化学 来源: 题型:
【题目】下列有关化学反应的叙述正确的是( )
A.MnO2和稀盐酸反应制取Cl2
B.过量氨水与SO2反应生成(NH4)2SO3
C.铁在浓硝酸中发生钝化
D.常温下钠与氧气反应生成Na2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于某有机物![]() 的性质叙述正确的是( )
的性质叙述正确的是( )
A. 1 mol该有机物可以与3 mol Na发生反应
B. 1 mol该有机物可以与3 mol NaOH发生反应
C. 1 mol该有机物可以与6 mol H2发生加成反应
D. 1 mol该有机物分别与足量Na或NaHCO3反应,产生的气体在相同条件下体积相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为C12H14O2的有机物F广泛用于制备香精的调香剂。为了合成该有机物,某实验室的科技人员设计了下列合成路线。
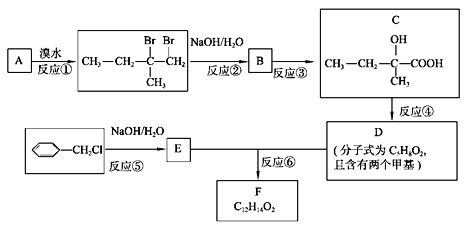
试回答下列问题:
(1) C物质中含有的官能团名称是__________,________;A物质的名称为_____________;
(2) 合成路线中反应③的反应类型为_________;
(3) 写出E的结构简式_________________,反应⑤的化学方程式为______________________;
(4) 按要求写出E的一种同分异构体的结构简式。要求:① 属于芳香族化合物。② 遇浓溴水能产生白色沉淀。___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤的工业加工过程中,可利用CO和H2合成甲醇,能量变化如图所示。下列说法正确的是
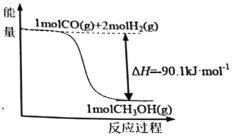
A.该反应是吸热反应
B.1molCH3OH所具有的能量为90.1kJ
C.CO(g)+2H2(g)![]() CH3OH(l) ΔH=-90.1kJ·mol-1
CH3OH(l) ΔH=-90.1kJ·mol-1
D.1molCO和2molH2断键所需能量小于1molCH3OH断键所需能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水综合利用要符合可持续发展的原则,其联合工业体系(部分)如图所示,下列说法不正确的是 ( )
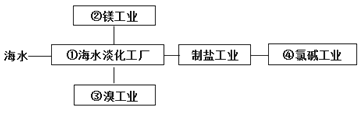
A.①中可采用蒸馏法
B.②中将MgCl2溶液蒸干即可得到无水MgCl2
C.③中提溴涉及到氧化还原反应
D.④的产品可生产盐酸、漂白液等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某化学兴趣小组为探究铜跟浓硫酸的反应,用如图所示装置进行有关实验。

(1) 装置A中发生反应的化学方程式为___________。
(2) 装置D中试管口放置的棉花应浸一种溶液,这种溶液是______,其作用是___________。
(3) 装置B的作用是贮存多余的气体,当D处有明显的现象后,关闭旋塞K,移去酒精灯, 但由于余热的作用,A处仍有气体产生,此时B中现象是____。
Ⅱ.乙酸乙酯广泛用于药物、染料、香料等工业,甲、乙两同学分别设计如下装置来 制备乙酸乙酯,已知:乙酸乙酯的沸点为77.1℃,CH3CH2OH![]() CH2=CH2↑+H2O。
CH2=CH2↑+H2O。
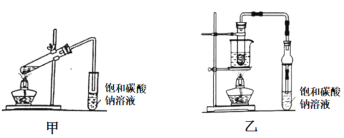
(1)甲装置中右边导管未插入溶液中的目的是 _________。
(2)实验结束后分离出乙酸乙酯的操作是______,必须用到的玻璃仪器有_______(填序号)。
A. 烧杯 B. 容量瓶 C. 分液漏斗 D. 蒸馏烧瓶
(3)乙装置优于甲装置的理由________ (写两条)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铍铜是力学、化学综合性能良好的合金,广泛应用于制造高级弹性元件。以下是从某废旧铍铜元件(含BeO25%、CuS71%、少量FeS和SiO2)中回收铍和铜两种金属的流程

已知:I.铍、铝元素处于周期表中的对角线位置,化学性质相似
Ⅱ.常温下: Ksp[Cu(OH)2]=2.2×10-20 Ksp[Fe(OH)3]=4.0×10-38 K sp[Mn(OH)2]=2.1×10-13
(1)滤液A的主要成分除NaOH外,还有______________ (填化学式)
写出反应I中含铍化合物与过量盐酸反应的离子方程式____________________________
(2)①溶液C中含NaCl、BeCl2和少量HCl,为提纯BeCl2,选择合理步骤并排序______________。
a加入过量的 NaOH b.通入过量的CO2 c加入过量的氨水
d.加入适量的HCl e.过滤 f洗涤
②从BeCl2溶液中得到BeCl2固体的操作是____________________________。
(3)①MnO2能将金属硫化物中的硫元素氧化为单质硫,写出反应Ⅱ中CuS发生反应的化学方程式________________________________________________________。
②若用浓HNO3溶解金属硫化物,缺点是______________ (任写一条)。
(4)溶液D中含c(Cu2+)=2.2mol·L-1、c(Fe3+)=0.008mol·L-1、c(Mn2+)=0.01mol·L-1,逐滴加入稀氨水调节pH可依次分离,首先沉淀的是______________ (填离子符号),为使铜离子开始沉淀,常温下应调节溶液的pH值大于______________。
(5)取铍铜元件1000g,最终获得Be的质量为81g,则产率是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】交联聚合物P的结构片段如图所示。下列说法不正确的是(图中![]() 表示链延长)
表示链延长)

A. 聚合物P中有酯基,能水解
B. 聚合物P的合成反应为缩聚反应
C. 聚合物P的原料之一丙三醇可由油脂水解获得
D. 邻苯二甲酸和乙二醇在聚合过程中也可形成类似聚合物P的交联结构
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com