

分析 根据流程可知,工业上以金红石(主要成分是TiO2)与焦炭、氯气反应生成四氯化钛及可燃性气体X,根据元素守恒可知,X为CO,TiCl4与镁在高温条件下发生置换反应生成钛和氯化镁,
(1)反应①中的反应方程式为TiO2+2C+2Cl2$\frac{\underline{\;高温\;}}{\;}$TiCl4+2C0,根据方程式可知氧化剂和还原剂的质量比;
(2)反应②为TiCl4与镁在高温条件下发生置换反应生成钛和氯化镁,据此书写化学方程式;
(3)TiCI4水解生成TiO2 ?xH2O,经焙烧得TiO2,在TiCI4水解时需要加人大量的水同时加热可以促进水解趋于完全;
(4)钛酸四丁脂〔Ti(O-C4H9)4〕水解生成Ti(OH)4和丁醇,据此书写化学方程式,制备纳米TiO2过程中如果水解的速度过快会生成絮凝物或沉淀,则得不到纳米TiO2.
解答 解:(1)反应①中的反应方程式为TiO2+2C+2Cl2$\frac{\underline{\;高温\;}}{\;}$TiCl4+2C0,根据方程式可知氧化剂为氯气,还原剂为碳,它们的质量比为71×2:12×2=71:12,
故答案为:71:12;
(2)反应②为TiCl4与镁在高温条件下发生置换反应生成钛和氯化镁,反应的化学方程式为2Mg+TiCl4$\frac{\underline{\;高温\;}}{\;}$2MgCl2+Ti,
故答案为:2Mg+TiCl4$\frac{\underline{\;高温\;}}{\;}$2MgCl2+Ti;
(3)TiCI4水解生成TiO2 ?xH2O,经焙烧得TiO2,在TiCI4水解时需要加人大量的水同时加热可以促进水解趋于完全,
故答案为:促进水解趋于完全;
(4)钛酸四丁脂〔Ti(O-C4H9)4〕水解生成Ti(OH)4和丁醇,反应的化学方程式为Ti(O-C4H9)4+4H2O→Ti(OH)4+4HO-C4H9,制备纳米TiO2过程中如果水解的速度过快会生成絮凝物或沉淀,则得不到纳米TiO2,
故答案为:Ti(O-C4H9)4+4H2O→Ti(OH)4+4HO-C4H9;防止钛酸四丁脂水解的速度过快会生成絮凝物或沉淀.
点评 本题考查氧化还原反应及水解反应,为高频考点,把握发生的反应及反应中元素的化合价变化为解答的关键,答题时注意对流程的分析,本题侧重分析与应用能力的考查,题目难度中等.


科目:高中化学 来源: 题型:解答题
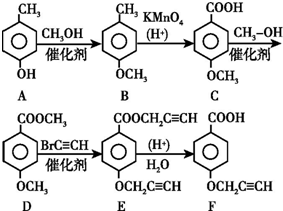
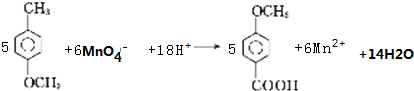 .
.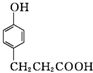 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeS04•7H20-绿矾 | B. | Na2O2-火碱 | C. | BaC03-重晶石 | D. | C6Hl206-庶糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
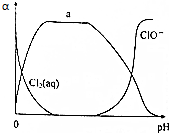 氯及其化合物在自来水消毒和果蔬保鲜等方面应用广泛.
氯及其化合物在自来水消毒和果蔬保鲜等方面应用广泛.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属铁与过量的稀盐酸反应:2Fe+6H+→2Fe3++3H2↑ | |
| B. | 氯化亚铁溶液中通入少量氯气:Fe2++Cl2→Fe3++2Cl- | |
| C. | 氧化铝与氢氧化钠溶液反应:Al2O3+2OH-=2AlO2-+H2O | |
| D. | 氯化铝溶液中加入过量的氨水:Al3++3OH-→Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 保持容器容积不变,向其加入1molH2(g),反应速率一定加快 | |
| B. | 保持容器容积不变,向其中加入1molN2(N2不参加反应),反应速率一定加快 | |
| C. | 保持容器内气体压强不变,向其中加入1molN2(N2不参加反应),反应速率一定加快 | |
| D. | 保持容器内气体压强不变,向其中加入1molH2(g)和1molI2(g),反应速率一定加快 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常作为气体的干燥剂 | B. | 常温下不能与铁发生反应 | ||
| C. | 滴在蔗糖上,蔗糖会变黑 | D. | 工业上主要采用接触法制备 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2的摩尔质量是64 g | |
| B. | 标准状况下18 g水的体积是22.4 L | |
| C. | 在标准状况下,20 mL NH3 与60 mL O2所含的分子数比为1:3 | |
| D. | 1mol/LMgCl2溶液中含有Cl-的数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、K+、SO42-、HCO3- | B. | Na+、K+、Cl?、SO42- | ||
| C. | Cu2+、K+、SO42-、NO3- | D. | Fe2+、K+、NO3-、Cl? |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com