
(1)某建筑材料,主要成分铝硅酸盐,化学式MgAl2H4Si4O14;化学式改写成氧化物形式为_____________。则材料该与足量的氢氧化钠反应后过滤,滤渣主要是______.写出该过程中发生的离子方程式_______________________________、_______________________________________。
(2)检验CO2中是否混有SO2可将气体通过盛有______的洗气瓶.
(3)鉴别Na2CO3和NaHCO3溶液可选用______(填序号).
①NaOH ②Ca(OH)2 ③BaCl2④K2SO4 ⑤Ca(NO3)2
(4)某溶液中有NH4+,Mg2+,Fe2+,Al3+四种离子,若向其中加入过量的氢氧化钠溶液,加热并搅拌,再加入过量盐酸,溶液中大量减少的阳离子是______.
A.NH4+ B.Mg2+ C.Fe2+ D.Al3+
(5)6.4gCu与过量硝酸(60mL 8mol/L)充分反应后,硝酸的还原产物有NO、NO2,反应后溶液中所含H+为n mol,NO、NO2混合气体的物质的量为________________
(1)MgO·Al2O3·4SiO2·2H2O,MgO,SiO2+2OH-=SiO32-+H2O,Al2O3+2OH-=2AlO2-+H2O;(2)品红溶液;(3)③⑤;(4)Fe2+、NH4+;(5)(0.28-n)mol
【解析】
试题分析:(1)硅酸盐改写成氧化物,顺序是金属氧化物、二氧化硅、水,如果有多种金属氧化物,按照金属活动顺序表书写;原子个数跟硅酸盐的组成一样。因此MgAl2H4Si4O14的氧化物形式为:MgO·Al2O3·4SiO2·2H2O,Al2O3是两性氧化物,SiO2是酸性氧化物,都可以跟NaOH溶液反应,而MgO是碱性氧化物,不与NaOH溶液反应,因此滤渣主要是MgO,反生的离子反应方程式:SiO2+2OH-=SiO32-+H2O,Al2O3+2OH-=2AlO2-+H2O;(2)利用SO2的漂白性可以使品红溶液褪色,而CO2不行,也可以用H2S溶液,SO2与H2S反应生成沉淀,而CO2不行,也可以用酸性该锰酸钾,SO2使酸性高锰酸钾褪色,而CO2不行;(3)①NaHCO3与NaOH反应无现象,不知发生反应,错误;②Ca(OH)2与Na2CO3、NaHCO3都反应生成沉淀,错误;③Ba2++CO32-=BaCO3↓,与NaHCO3不反应,正确;④都不反应,错误;⑤Ca2++CO32-=CaCO3↓,与NaHCO3不反应,正确;(4)A、NH4++OH- NH3↑+H2O,NH4+会减少,符合题意;B、Mg2++2OH-=Mg(OH)2↓,Mg(OH)2+2OH-=Mg2++2H2O,Mg2+不会减少,不符合题意;C、Fe2++2OH-=Fe(OH)2↓,4Fe(OH)2+O2+2H2O=4Fe(OH)3,Fe2+会减少,符合题意;D、Al3++4OH-=AlO2-+2H2O,AlO2-+4H+=Al3++2H2O,Al3+不会减少,不符合题意;(5)根据N元素守恒:n(HNO3)总=2n(Cu(NO3)2)+n(NO、NO2)+n(HNO3)剩余,n(NO、NO2)=0.28-n。
NH3↑+H2O,NH4+会减少,符合题意;B、Mg2++2OH-=Mg(OH)2↓,Mg(OH)2+2OH-=Mg2++2H2O,Mg2+不会减少,不符合题意;C、Fe2++2OH-=Fe(OH)2↓,4Fe(OH)2+O2+2H2O=4Fe(OH)3,Fe2+会减少,符合题意;D、Al3++4OH-=AlO2-+2H2O,AlO2-+4H+=Al3++2H2O,Al3+不会减少,不符合题意;(5)根据N元素守恒:n(HNO3)总=2n(Cu(NO3)2)+n(NO、NO2)+n(HNO3)剩余,n(NO、NO2)=0.28-n。
考点:考查改写成氧化物的形式、元素及其化合物的性质、化学计算等相关知识。


科目:高中化学 来源:2014-2015学年广东省肇庆市高三第一学期期末考试化学试卷(解析版) 题型:实验题
(17分)氯气在工农业生产中应用非常广泛。请回答以下问题:
(1)下面是三位同学分别设计的实验室制取和收集氯气的装置,其中最好的是 (填序号):

(2)某课外小组同学用如图所示装置通过电解食盐水并探究氯气相关性质,请回答:
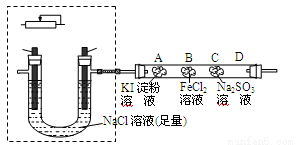
①现有电极:C和Fe供选择,请在虚框中补画导线、电源(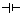 ),串联变阻器以调节电流,同时标出电极材料;电解的离子反应方程式为 。
),串联变阻器以调节电流,同时标出电极材料;电解的离子反应方程式为 。
②通电一段时间后,玻璃管A、B、C三处是浸有不同溶液的棉花,其中A、B两处的颜色变化分别为 、 ;C处发生的离子反应方程式为 。
③为防止氯气逸出造成污染,应采取的措施是 。
(3)当在阴极收集到气体448mL(标准状况)后停止实验,将U形管溶液倒于量筒中测得体积为400mL,则摇匀后理论上计算得溶液pH= 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市昌平区高二上学期期末考试化学试卷(解析版) 题型:选择题
(8分)现有下列物质:①乙炔 ②苯酚溶液 ③乙醛 ④氨基酸。请回答:
(1)能跟溴发生加成反应的是 (填序号,下同)。
(2)能跟银氨溶液发生银镜反应的是
(3)能跟饱和溴水反应生成白色沉淀的是
(4)能发生成肽反应的是
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市昌平区高二上学期期末考试化学试卷(解析版) 题型:选择题
 的命名正确的是
的命名正确的是
A.3-甲基丁烷 B.2-甲基戊烷
C.2-甲基丁烷 D.1,1-二甲基丙烷
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市昌平区高二上学期期末考试化学试卷(解析版) 题型:选择题
下列物质属于羧酸的是
A.HCHO B.CH3COOH C.CH3CH2OH D.CH3COOC2H5
查看答案和解析>>
科目:高中化学 来源:2014-2015天津市和平区高一上学期期末考试化学试卷(解析版) 题型:选择题
下列关于Na及其化合物的叙述正确的是
A.将钠投入FeSO4溶液中,可得到铁单质
B.足量Cl2,O2分别和两份等质量的Na反应,前者得到电子多
C.Na2O与Na2O2中阴阳离子个数比均为1:2
D.在2CO2+2Na2O2===2Na2CO3+O2反应中,每生成1molO2,消耗2mol氧化剂
查看答案和解析>>
科目:高中化学 来源:2014-2015天津市和平区高一上学期期末考试化学试卷(解析版) 题型:选择题
下列物质之间的反应,反应后一定有+3价铁生成的是
①过量的Fe与Cl2反应 ②Fe与过量稀硫酸反应后,再向其中加入硝酸钾
③硝酸亚铁溶液中,加入少量盐酸 ④铁和氧化铁的混合物溶于盐酸中
A.只有① B.只有①② C.只有①②③ D.全部
查看答案和解析>>
科目:高中化学 来源:2014-2015四川省绵阳市高一上学期期末化学试卷(解析版) 题型:选择题
将V L AlCl3和KCl的混合溶液均分成两份,一份滴加氨水,使Al3+离子完全沉淀;另一份滴加AgNO3溶液,使Cl-离子完全沉淀。反应消耗a mol NH3·H2O、b mol AgNO3。据此得知原混合溶液中的c(K+)为
A.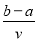 mol/L B.
mol/L B. mol/L
mol/L
C. mol/L D.
mol/L D. mol/L
mol/L
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市西城区高三上学期期末考试化学试卷(解析版) 题型:填空题
17.(共6分)金属Na、Mg、Al有广泛的应用。
(1)周期表中Na、Mg、Al所在周期是 。
(2)为比较Na、Mg、Al的金属性,进行了如下实验:
实验1:各取1.0 g金属钠和镁,分别加入到5 mL水中,钠与水反应剧烈,镁与水反应缓慢。
实验2:各取1.0 g的镁条和铝条,分别加入到5 mL 1.0 mol/L盐酸中,镁与盐酸反应剧烈,铝与盐酸反应较剧烈。
已知:元素金属性强弱可以从其单质与水(或酸)反应置换出氢的难易程度来判断。
由实验1和实验2得出的结论是 ,用原子结构理论解释:同周期元素从左到右, 。
(3)Na、Mg、Al都可以用于制备储氢的金属氢化物。
① NaH是离子化合物,能与水发生氧化还原反应生成H2,该反应的还原剂是 。
② NaAlH4是一种良好的储氢材料。NaAlH4与水反应的化学方程式是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com