
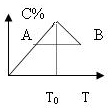
 对于反应2A+B?2C的反应过程中C的百分含量随温度的变化如图所示,则:
对于反应2A+B?2C的反应过程中C的百分含量随温度的变化如图所示,则:分析 (1)由图可知,温度T0前,C的质量分数增大,故未达平衡,反应向正反应进行,温度T0后,C的质量分数减小,平衡向逆反应进行,故温度T0时,反应到达平衡状态;
(2)温度升高平衡向逆反应移动,故正反应为放热反应;
(3)A、B两点,各组分的浓度相同,温度越高反应速率与快.
解答 解:(1)由图可知,温度T0前,C的质量分数增大,故未达平衡,反应向正反应进行,温度T0后,C的质量分数减小,平衡向逆反应进行,故温度T0时,反应到达平衡状态,故v正=v逆,
故答案为:v正=v逆;
(2)温度升高平衡向逆反应移动,故正反应为放热反应,
故答案为:放;
(3)A、B两点,各组分的浓度相同,温度越高反应速率越快,故VA<VB,
故答案为:vA<vB.
点评 本题考查化学平衡图象、影响化学平衡的因素等,为高频考点,侧重于学生的分析能力的考查,难度中等,注意根据C的质量分数判断温度T0前未达平衡,从T0后为平衡状态.


科目:高中化学 来源: 题型:选择题
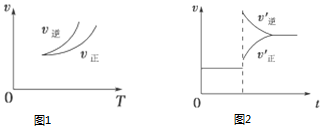
| A. | 图1说明正反应为吸热反应 | |
| B. | 反应达平衡后,增大压强气体密度将减小 | |
| C. | 图2可表示升高温度使平衡向逆反应方向移动 | |
| D. | 图2虚线可表示使用催化剂后引发的反应速率变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 化学键 | O═O | C≡O | C═O |
| 键能(kJ/mol) | 497 | 1072 | 803 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有①③⑦ | B. | 除①⑧外 | C. | 除⑥外 | D. | 只有②⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
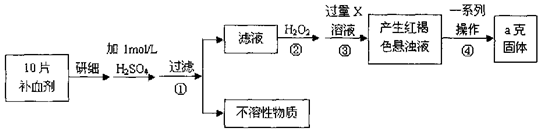
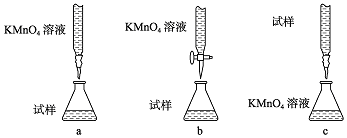
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑧⑤⑦ | B. | ③②⑧①⑤⑦ | C. | ④⑤⑧⑥⑦① | D. | ①③⑧⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Cl>Na>O>N | B. | 碱性:NaOH<Mg(OH)2<Al(OH)3 | ||
| C. | 熔点:CBr4>CCl4>CF4 | D. | 热稳定性:HF>HCl>H2S>H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应①中硝酸铵既是氧化剂又是还原剂,H2O是氧化产物 | |
| B. | 反应②中K2SO3是还原剂,N2O是氧化产物 | |
| C. | 反应③中每生成1 mol N2O,转移8 mol电子 | |
| D. | 反应④中NaNO3是还原剂,N2O既是氧化产物又是还原产物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com