
【题目】NA 为阿伏加德罗常数的值,下列说法正确的是
A. 标准状况下,2.24L CCl4中含有的分子总数为0.1NA
B. 78 g Na2O2中含有的阴离子数为NA
C. 金属钠与水反应,生成22.4L氢气时,转移的电子数为2NA
D. 将含有1mol溶质的FeCl3溶液加入沸水中制取Fe(OH)3胶体,其含Fe(OH)3胶粒数为NA
【答案】B
【解析】
A.标准状况下的CCl4是液态物质,不能应用公式n=![]() 计算其物质的量,所以无法确定2.24LCCl4中含有的分子数。A项错误;
计算其物质的量,所以无法确定2.24LCCl4中含有的分子数。A项错误;
B.Na2O2的摩尔质量为78g/mol,即78gNa2O2的物质的量为1mol,由Na2O2的电子式 可知,每个“Na2O2”中含有1个阴离子(
可知,每个“Na2O2”中含有1个阴离子(![]() ),所以1mol Na2O2中含有1mol
),所以1mol Na2O2中含有1mol![]() ,即78 g Na2O2中含有的阴离子数为NA,B项正确;
,即78 g Na2O2中含有的阴离子数为NA,B项正确;
C.根据反应方程式![]() 可知,每生成1molH2转移2mol电子,但题目未明确氢气是否处于标准状况,无法计算22.4L氢气生成时转移的电子数。C项错误;
可知,每生成1molH2转移2mol电子,但题目未明确氢气是否处于标准状况,无法计算22.4L氢气生成时转移的电子数。C项错误;
D.Fe(OH)3胶体粒子是由许多Fe(OH)3分子聚集在一起形成的颗粒,其颗粒直径恰好在1nm~100nm之间,所以1molFeCl3形成的Fe(OH)3胶体粒子数目要小于NA,D项错误;答案选B。


科目:高中化学 来源: 题型:
【题目】不锈钢主要是由铁、镍、铜、碳等元素所组成的合金。具有优异的抗腐蚀性能。
(1)铁元素在周期表中的位置是________________,其基态原子的价电子排布图为___________________,基态三价阳离子最外层有________种运动状态不同的电子。
(2)金属镍粉在CO气流中轻微加热,生成无色挥发性液体Ni(CO)n ,Ni(CO)n晶体属于___(填晶体类型)。写出一个与Ni(CO)n中配体互为等电子体的离子的化学式为___________。
(3)已知铜晶体为面心立方最密堆积,若该晶体中一个晶胞的边长为a cm,则铜晶体的密度为________________g/cm3(写出含a的表达式,用NA表示阿伏加德罗常数的值)。若铜的原子半径为r cm ,则在铜晶胞中用r表示出这种堆积模型的空间利用率为_________(保留两位小数)。
(4)邻羟基苯甲酸(又名水杨酸,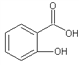 )和对羟基苯甲酸(
)和对羟基苯甲酸(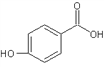 )都是二元酸。二者沸点相差较大的理由是_______________________________。已知苯酚(
)都是二元酸。二者沸点相差较大的理由是_______________________________。已知苯酚(![]() )具有弱酸性,其Ka=1.1×10-10;水杨酸第一级电离形成的离子
)具有弱酸性,其Ka=1.1×10-10;水杨酸第一级电离形成的离子![]() 能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka2(水杨酸)_______Ka(苯酚)(填“>”或“<”)。
能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka2(水杨酸)_______Ka(苯酚)(填“>”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2.1g平均相对分子质量为7.2的CO与H2组成的混合气体与足量的O2充分燃烧后,立即通入足量的Na2O2固体中,固体的质量增加
A. 2.1g B. 3.6g C. 7.2g D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,在密闭容器中合成氨反应如下:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ/mol,下列叙述正确的是
2NH3(g) ΔH=-92.4 kJ/mol,下列叙述正确的是
A. 混合气体的质量不变时,说明该反应一定达到平衡状态
B. 将容器的体积扩大到原来的2倍,v(正)减小,v(逆)增大,平衡向左移动
C. 1mol N2(g)和3 mol H2(g)的总键能大于2 mol NH3(g)的总键能
D. 在密闭容器中通入1mol N2和3 mol H2进行反应,测得反应放出的热量小于92.4 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2O和CO是环境污染性气体,可在Pt2O+表面转化为无害气体,其反应为:N2O(g)+CO(g)![]() CO2(g)+N2(g)ΔH,有关化学反应的物质变化过程如图1,能量变化过程如图2。下列说法正确的是
CO2(g)+N2(g)ΔH,有关化学反应的物质变化过程如图1,能量变化过程如图2。下列说法正确的是
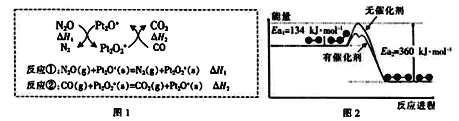
A. 由图1可知:ΔH1=ΔH+ΔH2
B. 由图2可知:ΔH=-226kJ/mol
C. 由图2可知:反应①的反应速率比反应②快
D. 为了实现转化需不断向反应器中补充Pt2O+和Pt2O2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化碳加氢合成乙烯的反应如下:2CO2(g )+6H2(g)![]() C2H4(g)+4H2O(g) ΔH。
C2H4(g)+4H2O(g) ΔH。
已知:①C2H4(g)+3O2(g)=2CO2(g)+2H2 ΔH1=a kJ/mol;
②2H2(g)+O2(g)=2H2O(1)ΔH2=bkJ/mol;
③H2O(1)=H2O(g) ΔH3=c kJ/mol;
请回答:
(1)ΔH=____kJ/mol。(用a、b、c 表示)
(2)在催化剂[Fe3(CO)12/ZSM-5]、空速1200 h-1 条件下,温度、压强、氢碳比[n(H2)/n(CO2)=x]对CO2平衡转化率及温度对催化效率影响如图1所示。
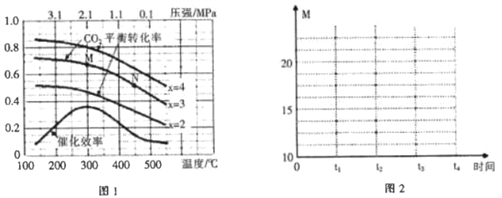
①下列有关说法正确的是________(填字母)。
A.ΔH>0
B.增大氢碳比,可以提高CO2的平衡转化率
C.温度低于300℃时,随温度升高乙烯的产率增大
D.平衡常数:K(M)>K(N)
E.为提高CO2的平衡转化率,工业生产中应在尽可能低的温度下合成乙烯
②M点时,CO2的平衡转化率为2/3,则此时平衡体系中乙烯的体积分数为_________。
③工业生产中压强一般控制在2.1~2.6 MPa之间,理由是____________________________。
(3)恒温(300℃),在体积为1L的恒容容器中以n(H2)/n(CO2)=3的投料比加入反应物,至t1时达到平衡。t2时将容器体积瞬间扩大至2 L并保持不变,t3时重新达平衡。在图2中绘制0~t4时间段内,容器内混合气体的平均相对分子质量(M)随时间(t)变化的图像。_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象描述正确的是
选项 | 实验 | 现象 |
A | 向饱和Na2CO3溶液中通入足量的CO2气体 | 无明显现象 |
B | 在酒精灯上加热铝箔 | 铝箔熔化,失去光泽,熔化的铝滴落下来 |
C | 向Al2(SO4)3溶液中滴加过量NaOH溶液 | 产生大量白色沉淀 |
D | 加热放在坩埚中的小块钠 | 钠先熔化成光亮的小球,燃烧时火焰为黄色,燃烧后生成淡黄色固体 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组用铝箔制备Al2O3、AlCl3·6H2O及明矾大晶体,具体流程如下:

已知:AlCl3·6H2O易溶于水、乙醇及乙醚;明矾在水中的溶解度如下表。
温度/℃ | 0 | 10 | 20 | 30 | 40 | 60 | 80 | 90 |
溶解度/g | 3.00 | 3.99 | 5.90 | 8.39 | 11.7 | 24.8 | 71.0 | 109 |
请回答:
(1)步骤Ⅰ中的化学方程式_________;步骤Ⅱ中生成Al(OH)3的离子方程式___________。
(2)步骤Ⅲ,下列操作合理的是____________。
A.坩埚洗净后,无需擦干,即可加入Al(OH)3灼烧
B.为了得到纯Al2O3,需灼烧至恒重
C.若用坩埚钳移动灼热的坩埚,需预热坩埚钳
D.坩埚取下后放在石棉网上冷却待用
E.为确保称量准确,灼烧后应趁热称重
(3)步骤Ⅳ,选出在培养规则明矾大晶体过程中合理的操作并排序_______________。
①迅速降至室温 ②用玻璃棒摩擦器壁 ③配制90℃的明矾饱和溶液 ④自然冷却至室温 ⑤选规则明矾小晶体并悬挂在溶液中央 ⑥配制高于室温10-20℃的明矾饱和溶液
(4)由溶液A制备AlCl3·6H2O的装置如下图:

①通入HCl的作用是抑制AlCl3水解和________________________。
②步骤Ⅴ,抽滤时,用玻璃纤维替代滤纸的理由是_____;洗涤时,合适的洗涤剂是_____。
③步骤Ⅵ,为得到纯净的AlCl3·6H2O,宜采用的干燥方式是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,相同pH的盐酸和醋酸溶液分别加水稀释,平衡时pH随溶液体积变化的曲线如图所示。据图判断不正确的是( )
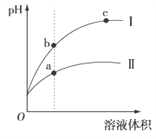
A. I是盐酸,Ⅱ是醋酸
B. 稀释前等体积的I、Ⅱ溶液中和氢氧化钠的能力相同
C. a、b、c三点KW的数值相同
D. 溶液的导电性a>b>c
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com