
已知短周期元素的离子,aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述正确的是
A.原子半径 A>B>D>C B.原子序数 a>b>d>c
C.离子半径 C>D>B>A D.单质的还原性 A>B>D>C
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:
(CH3)3NH+和AlCl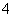 可形成离子液体。离子液体由阴、阳离子组成,熔点低于100℃,其挥发性一般比有机溶剂________(填“大”或“小”),可用作____________(填代号)。
可形成离子液体。离子液体由阴、阳离子组成,熔点低于100℃,其挥发性一般比有机溶剂________(填“大”或“小”),可用作____________(填代号)。
a.助燃剂 b.“绿色”溶剂
c.复合材料 d.绝热材料
查看答案和解析>>
科目:高中化学 来源: 题型:
有关晶体的下列说法中正确的是
A.晶体中分子间作用力越大,分子越稳定 B.原子晶体中共价键越强,熔点越高
C.冰融化时水分子中共价键发生断裂 D.氯化钠熔化时离子键未被破坏
查看答案和解析>>
科目:高中化学 来源: 题型:
当今世界,能源的发展日益成为全世界、全人类共同关心的问题。
A和B的单质单位质量的燃烧热大,可用作燃料。已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
| 电离能(kJ/mol) | I1 | I2 | I3 | I4 |
| A | 899 | 1 757 | 14 840 | 21 000 |
| B | 738 | 1 451 | 7 733 | 10 540 |
①请根据上述信息,写出A的核外电子排布式:__________________。
②某同学根据上述信息,推断B的核外电子排布如图1所示,该同学所画的电子排布图违背了______________________。
(2)氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料。
①已知金刚石中碳碳键的键长为154.45 pm,C60中碳碳键的键长为145 pm和140 pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确并阐述理由, 理由:___________________________________________ _。
②科学家把C60和K掺杂在一起制造了一种富勒烯化合物,其晶胞如图2所示,该物质在低温时是一种超导体。该物质中K原子和C60分子的个数比为____________。
③继C60后,科学家又合成Si60、N60,请比较C、Si、N原子电负性由大到小的顺序 。Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则一个Si60分子中所含π键的数目为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA表示阿伏加德罗常数,下列说法正确的是( )
A、1mol氯气参加氧化还原反应,转移的电子数一定为2 NA
B、0.1mol Fe与0.1mol Cl2充分反应,转移的电子数为0.3NA
C、常温常压下,44g二氧化碳分子中所形成的共用电子对数为2 NA
D、常温常压下,1.6gO2和O3混合气体中质子总数为0.8NA
查看答案和解析>>
科目:高中化学 来源: 题型:
有一混合溶液中含有以下离子中的若干:K+、NH4+、Cl-、HCO3-、SO32-、SO42-、Ag+。现取等体积的两份溶液进行如下实验:
(1)第一份加入足量的NaOH溶液,无沉淀;加热,收集到标准状况下的气体336 mL。
(2)第二份加入足量的用盐酸酸化的BaCl2溶液,产生2.33g白色沉淀,同时收集到标准状况下的气体336 mL,该气体能使品红溶液褪色。
根据上述实验,下列推断正确的是( )
A. K+一定存在 B. Ag+和Cl-一定不存在
C. HCO3-一定不存在 D. 混合溶液中一定有0.015 mol SO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
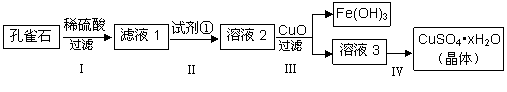 孔雀石主要成分是Cu2(OH)2CO3,还含少量难溶的FeCO3及Si的化合物,实验室以孔雀石为原料制备硫酸铜晶体的步骤如下:
孔雀石主要成分是Cu2(OH)2CO3,还含少量难溶的FeCO3及Si的化合物,实验室以孔雀石为原料制备硫酸铜晶体的步骤如下:
(1)步骤Ⅰ中涉及的反应用离子方程式表示为_____________________________。
(2)为将溶液中Fe2+氧化成Fe3+步骤Ⅱ中加入的试剂①最好是__________(填代号)。
a.KMnO4 b.H2O2 c.Fe粉 d.KSCN
(3)步骤Ⅳ获得硫酸铜晶体,需要经过_________、_________、过滤等操作。
(4)孔雀石与焦炭一起加热可以生成Cu及其它无毒物质,写出该反应的化学方程式_____________。
(5)测定硫酸铜晶体(CuSO4·xH2O)中结晶水的x值:称取2.5g硫酸铜晶体,加热至质量不再改变时,称量粉末的质量为1.6g。则计算得x=______
查看答案和解析>>
科目:高中化学 来源: 题型:
随着汽车数量的逐年增多,汽车尾气污染已成为突出的环境问题之一。反应:2NO(g)+2CO(g) 2CO2(g)+N2(g)可用于净化汽车尾气,已知该反应速率极慢,570 K时平衡常数为1×1059。下列说法正确的是( )
2CO2(g)+N2(g)可用于净化汽车尾气,已知该反应速率极慢,570 K时平衡常数为1×1059。下列说法正确的是( )
A.提高尾气净化效率的最佳途径是研制高效催化剂
B.提高尾气净化效率的常用方法是升高温度
C.装有尾气净化装置的汽车排出的气体中不再含有NO或CO
D.570 K时及时抽走CO2、N2,平衡常数将会增大,尾气净化效率更佳
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com