
一定温度下,在一固定体积的容器中,通人一定量的CO和H2O,发生如下反应:CO(g)十H2O(g)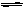 CO2(g)十H2 (g) △H<0。在850℃时,CO和H2O浓度变化如下左图;若在t1℃时,在相同容器中发生上述反应,容器内各物质的浓度变化如右表。下列说法正确的是:
CO2(g)十H2 (g) △H<0。在850℃时,CO和H2O浓度变化如下左图;若在t1℃时,在相同容器中发生上述反应,容器内各物质的浓度变化如右表。下列说法正确的是:
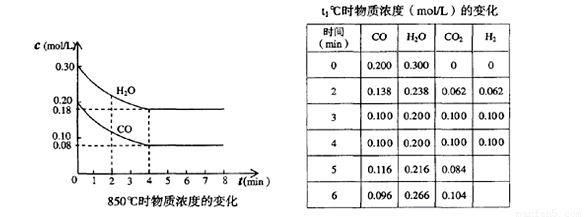
A.850℃时,按左图所示0~4min用CO2表示的平均反应速率v(CO2)=0.02mol·L-1·min-1
B.t1℃高于850℃
C.t1℃时,反应在4min~5min间,平衡向逆反应方向移动,若其它条件不变,可能的原因是增大压强
D.若t2℃时,各物质的平衡浓度符合c(CO2)·c(H2)=2 [c(CO)·c(H2O)],则t2℃高于850℃
B
【解析】
试题分析:A、因图中没有CO2的浓度变化曲线,所以只有通过CO 和H2O浓度,通过三段式间接计算CO2的变化浓度,即 CO(g)十H2O(g)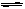 CO2(g)十H2 (g)
CO2(g)十H2 (g)
起始浓度(mol/L) 0.2 0.3 0 0
转化浓度(mol/L) 0.12 0.12 0.12 0.12
平衡浓度(mol/L) 0.08 0.18 0.12 0.12
4分钟时浓度不变,达到平衡,则v(CO2)=0.12mol/L÷4min=0.03 mol·L-1·min-1,A不正确;
B、观察右表数据,第3分钟时达到平衡,说明达到平衡的时间缩短,速率更快,则温度应该更高,所以B正确;
C、根据方程式计量数可知,该反应是体积不变的,即使增大压强,平衡也不移动,而表中数据说明4~5分钟时,CO和H2O的浓度再增大,CO2的浓度再减小,平衡应该是逆向移动,可能的原因是升高温度,C不正确;
D、根据方程式可知,该反应的平衡常数表达式K=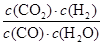 ,850℃时K=
,850℃时K= =1。此时(CO2)·c(H2)=2 [c(CO)·c(H2O)],即K=2>1。这说明平衡正向移动,则温度降低,应低于850℃,D不正确,答案选B。
=1。此时(CO2)·c(H2)=2 [c(CO)·c(H2O)],即K=2>1。这说明平衡正向移动,则温度降低,应低于850℃,D不正确,答案选B。
考点:考查反应速率的计算;平衡常数的应用以及外界条件对反应速率和平衡状态的影响


 作业辅导系列答案
作业辅导系列答案科目:高中化学 来源: 题型:

| A、850℃时,按左图所示0~4min用CO2表示的平均反应速率v(CO2)=0.02mol?L-1?min-1 | B、t1℃高于850℃ | C、t1℃时,反应在4min~5min间,平衡向逆反应方向移动,若其它条件不变,可能的原因是增大压强 | D、若t2℃时,各物质的平衡浓度符合c(CO2)?c(H2)=2[c(CO)?c(H2O)],则t2℃高于850℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,在一固定体积的容器中,通人一定量的CO和H2O,发生如下反应:CO(g)十H2O(g)![]() CO2(g)十H2 (g);△H<0
CO2(g)十H2 (g);△H<0
(1)在850℃时,CO和H2O浓度变化如下左图,则 0~4min的平均反应速率v(CO)=_ _mol·L-1·min-1

(2)t1℃时,在相同容器中发生上述反应,容器内各物质的浓度变化如右上表。
①计算t1℃该反应的平衡常数为 ,t1℃ 850℃(填大于、小于或等于)。判断依据是________ _______。
②t1℃时,反应在4min—5min间,平衡 移动(填“向左”、“向右”或“不移动”),可能的原因是________。
a.增加CO的浓度 b.增加H2的浓度
c.加压 d.使用催化剂
(3)t2℃时,反应CO2(g)十H2 (g)![]() CO(g)十H2O(g)的平衡浓度符合[CO2]·[H2]=2[CO]·[H2O],则t2℃ 850℃(填大于、小于或等于)。
CO(g)十H2O(g)的平衡浓度符合[CO2]·[H2]=2[CO]·[H2O],则t2℃ 850℃(填大于、小于或等于)。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年广东省三校高二下学期联考化学试卷(带解析) 题型:填空题
(12分)一定温度下,在一固定体积的容器中,通入一定量的CO和H2O,
发生如下反应:CO (g) 十H2O (g)  CO2 (g) 十 H2 (g) ; △H<0
CO2 (g) 十 H2 (g) ; △H<0
(1)在850℃时,CO和H2O浓度变化如下左图,则 0~4min的平均反应速率v(CO2)= _mol·L-1·min-1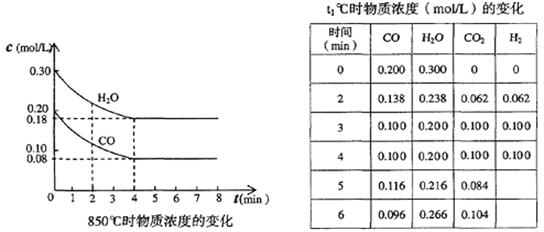
(2)t1℃时,在相同容器中发生上述反应,各物质的浓度变化如右上表:
① 计算t1℃该反应的平衡常数为K = 。
② t1℃时,反应在5min~6min间,平衡 移动(填向左、向右或不 ),若在第5分钟改变一种条件达到第6分钟的浓度,改变的条件是 ________。
(3)t2℃时,化学反应CO (g) + H2O (g)  CO2 (g) + H2 (g)的平衡浓度符合c(CO2)·c(H2)=2 c(CO)·c(H2O),则t2℃ 850℃,判断依据是:
CO2 (g) + H2 (g)的平衡浓度符合c(CO2)·c(H2)=2 c(CO)·c(H2O),则t2℃ 850℃,判断依据是:
查看答案和解析>>
科目:高中化学 来源:2012年苏教版高中化学选修6 4.3反应条件对化学平衡的影响练习卷(解析版) 题型:选择题
一定温度下,在一固定容积的密闭容器中发生反应:2NO2(g)  N2O4(g),达平衡时,再向容器内通入一定量的NO2,重新达到平衡后,与第一次平衡相比,NO2的体积分数( )
N2O4(g),达平衡时,再向容器内通入一定量的NO2,重新达到平衡后,与第一次平衡相比,NO2的体积分数( )
A.不变 B.增大
C.减小 D.无法判断
查看答案和解析>>
科目:高中化学 来源:2013届广东省三校高二下学期联考化学试卷(解析版) 题型:填空题
(12分)一定温度下,在一固定体积的容器中,通入一定量的CO和H2O,
发生如下反应:CO (g) 十H2O (g)  CO2 (g) 十 H2
(g) ; △H<0
CO2 (g) 十 H2
(g) ; △H<0
(1)在850℃时,CO和H2O浓度变化如下左图,则 0~4min的平均反应速率v(CO2)= _ mol·L-1·min-1
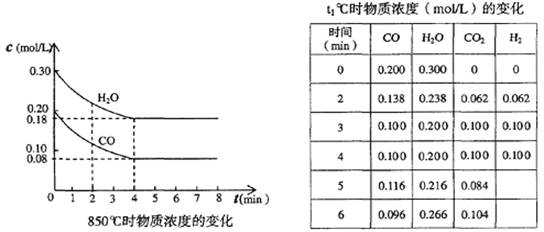
(2)t1℃时,在相同容器中发生上述反应,各物质的浓度变化如右上表:
① 计算t1℃该反应的平衡常数为K = 。
② t1℃时,反应在5min~6min间,平衡 移动(填向左、向右或不 ),若在第5分钟改变一种条件达到第6分钟的浓度,改变的条件是 ________。
(3)t2℃时,化学反应CO (g) + H2O (g)  CO2
(g) + H2 (g)的平衡浓度符合c(CO2)·c(H2)=2 c(CO)·c(H2O),则t2℃ 850℃, 判断依据是:
CO2
(g) + H2 (g)的平衡浓度符合c(CO2)·c(H2)=2 c(CO)·c(H2O),则t2℃ 850℃, 判断依据是:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com