
锌烂板液是制作印刷锌板时用稀HNO3腐蚀锌板后得到的废液,主要含Zn(NO3)2和自来水带进的Cl-、Fe3+等杂质离子。某兴趣小组在实验室中由锌烂板液制取ZnSO4·7H2O的步骤如下:
①在锌烂板液中逐渐加入6 mol/L氢氧化钠溶液,用pH试纸检验,直至pH=8;
②过滤后得到粗Zn(OH)2沉淀,用蒸馏水多次洗涤沉淀;
③用2 mol/L硫酸慢慢将洗净的粗Zn(OH)2沉淀溶解,保持一定pH,加热煮沸,趁热过滤,滤液即为ZnSO4溶液;
④在滤液中注入2 mol/L的硫酸,调节pH为2左右,后经相关操作得到ZnSO4·7H2O晶体。
已知:常温下,Fe3+在pH=1.9开始沉淀,pH=3.2沉淀完全;Zn2+在pH=6.4开始沉淀,pH=8.0沉淀完全;Zn(OH)2的化学性质与Al(OH)3相似。
(1)在以上所有步骤中都需要用到的仪器是烧杯、___________。
(2)步骤②的目的是除去________________等杂质离子,检验沉淀是否已洗净的具体操作是________________。
(3)步骤①保持pH=8的目的是________________,步骤④保持pH =2的目的是________________。
(4)步骤③为了除去Fe3+,故保持的pH范围为_____________,加热煮沸的目的是________________。
(5)步骤④中得到ZnSO4·7H2O晶体的操作步骤为____________、________________、过滤、洗涤、干燥。
解析:本题考查了硫酸锌晶体的制备,意在考查考生的实验操作能力和分析能力。(1)实验过程中,各步骤都需要用到烧杯和玻璃棒。(2)步骤②的目的是除去Cl-、NO 、Na+等杂质离子,以提高纯度;检验沉淀是否已洗净,可检验滤液中是否含有Cl-,方法是取最后一次洗涤滤液少量于试管中,滴加硝酸酸化的AgNO3溶液,若无白色沉淀产生,说明沉淀已洗涤干净。(3)根据题给信息,Zn2+在pH=6.4开始沉淀,在pH=8.0沉淀完全,故步骤①保持pH=8,既保证Zn2+完全沉淀,又避免Zn(OH)2溶解。步骤④保持pH=2的目的是避免Zn2+水解。(4)根据题给信息,Fe3+在pH=1.9开始沉淀,在pH=3.2沉淀完全,而又不能让Zn2+沉淀出来,故步骤③保持的pH范围为3.2~6.4;加热可以促使Fe3+充分水解。(5)步骤④中得到ZnSO4·7H2O晶体的操作为蒸发浓缩、冷却结晶,然后过滤、洗涤、干燥。
、Na+等杂质离子,以提高纯度;检验沉淀是否已洗净,可检验滤液中是否含有Cl-,方法是取最后一次洗涤滤液少量于试管中,滴加硝酸酸化的AgNO3溶液,若无白色沉淀产生,说明沉淀已洗涤干净。(3)根据题给信息,Zn2+在pH=6.4开始沉淀,在pH=8.0沉淀完全,故步骤①保持pH=8,既保证Zn2+完全沉淀,又避免Zn(OH)2溶解。步骤④保持pH=2的目的是避免Zn2+水解。(4)根据题给信息,Fe3+在pH=1.9开始沉淀,在pH=3.2沉淀完全,而又不能让Zn2+沉淀出来,故步骤③保持的pH范围为3.2~6.4;加热可以促使Fe3+充分水解。(5)步骤④中得到ZnSO4·7H2O晶体的操作为蒸发浓缩、冷却结晶,然后过滤、洗涤、干燥。
答案:(1)玻璃棒(1分)
(2)Cl-、NO 、Na+(2分) 取最后一次洗涤滤液少量于试管中,滴加硝酸酸化的AgNO3溶液,若无白色沉淀产生,说明沉淀已洗涤干净(2分)
、Na+(2分) 取最后一次洗涤滤液少量于试管中,滴加硝酸酸化的AgNO3溶液,若无白色沉淀产生,说明沉淀已洗涤干净(2分)
(3)既保证Zn2+完全沉淀,又避免Zn(OH)2溶解(1分) 避免Zn2+水解(1分)
(4)3.2~6.4(2分) 促使Fe3+充分水解(1分)
(5)蒸发浓缩(1分) 冷却结晶(1分)


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
既可以用来鉴别甲烷和乙烯,又可以用来除去甲烷中混有的少量乙烯的是( )
A.气体通过盛有酸性高锰酸钾溶液的洗气瓶
B.气体通过盛有足量溴水的洗气瓶
C.气体通过盛有足量蒸馏水的洗气瓶
D.气体与适量HCl混合
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是 ( )
A.所有不锈钢都只含有金属元素
B.我国流通的硬币材质是金属单质
C.广东打捞的明代沉船上存在大量铝制餐具
D.镁合金的硬度和强度均高于纯镁
查看答案和解析>>
科目:高中化学 来源: 题型:
已知AgI为黄色沉淀,AgCl为白色沉淀,25 ℃时,AgI饱和溶液中c(Ag+)=1.22×10-8 mol·L-1,AgCl饱和溶液中c(Ag+)=1.30×10-5 mol·L-1。若在5 mL含有KCl和KI浓度均为0.01 mol·L-1的混合溶液中,滴加8 mL 0.01 mol·L-1的AgNO3溶液,则下列叙述中不正确的是( )
A.溶液中所含溶质的离子浓度大小关系为c(NO )>c(K+)>c(Cl-)>c(I-)>c(Ag+)
)>c(K+)>c(Cl-)>c(I-)>c(Ag+)
B.溶液中先产生的是AgI沉淀
C.AgCl的Ksp的数值为1.69×10-10
D.若在AgI悬浊液中滴加KCl溶液、黄色沉淀可能转变成白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
已知Ksp(AgCl)=1.78×10-10,Ksp(Ag2CrO4)=2.00×10-12。在只含有KCl、K2CrO4的混合溶液中滴加0.001 mol·L-1的AgNO3溶液,当AgCl与Ag2CrO4共存时,测得溶液中CrO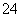 的浓度是5.000×10-3 mol·L-1,此时溶液中Cl-的物质的量浓度是( )
的浓度是5.000×10-3 mol·L-1,此时溶液中Cl-的物质的量浓度是( )
A.1.36×10-5 mol·L-1 B.8.90×10-6 mol·L-1
C.4.45×10-2 mol·L-1 D.1×10-5 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.汽油、柴油和植物油都是碳氢化合物
B.淀粉和蛋白质均可作为生产葡萄糖的原料
C.石油裂化和油脂皂化都是高分子生成小分子的过程
D.装饰材料中的甲醛和芳香烃会造成居室污染
查看答案和解析>>
科目:高中化学 来源: 题型:
 为有效控制雾霾,各地积极采取措施改善大气质量,研究并有效控制空气中的氮氧化物、碳氧化物和硫氧化物含量显得尤为重要。
为有效控制雾霾,各地积极采取措施改善大气质量,研究并有效控制空气中的氮氧化物、碳氧化物和硫氧化物含量显得尤为重要。
(1)汽车内燃机工作时会引起N2和O2的反应: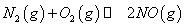 ,是导致汽车尾气中含有NO的原因之一。
,是导致汽车尾气中含有NO的原因之一。
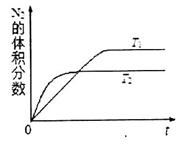
①在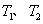 温度下,一定量的NO发生分解反应时N2的体积分数随时间变化如右图所示,根据图像判断反应
温度下,一定量的NO发生分解反应时N2的体积分数随时间变化如右图所示,根据图像判断反应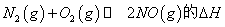 __________0(填“>”或“<”)。
__________0(填“>”或“<”)。
②在 温度下,向2L密闭容器中充入10molN2与5mo1O2,50秒后达到平衡,测得NO的物质的量为2mol,则该反应的速率
温度下,向2L密闭容器中充入10molN2与5mo1O2,50秒后达到平衡,测得NO的物质的量为2mol,则该反应的速率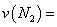 ___________________。该温度下,若开始时向上述容器中充入N2与O2均为1 mol,则达到平衡后N2的转化率为____________。
___________________。该温度下,若开始时向上述容器中充入N2与O2均为1 mol,则达到平衡后N2的转化率为____________。
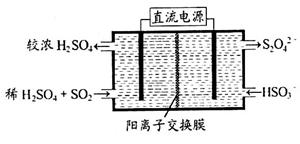 (2)利用右图所示装置(电极均为惰性电极)可吸收SO2,用阴极排出的溶液可吸收NO2。
(2)利用右图所示装置(电极均为惰性电极)可吸收SO2,用阴极排出的溶液可吸收NO2。
①阳极的电极反应式为_____________________。
②在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时有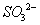 生成。该反应中氧化剂与还原剂的物质的量之比为_______________。
生成。该反应中氧化剂与还原剂的物质的量之比为_______________。
(3)一定条件下可用甲醇与CO反应生成醋酸消除CO污染。常温下,将a mol·L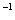 的醋酸与b mol
的醋酸与b mol L
L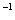
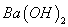 溶液等体积混合,充分反应后,溶液中存在
溶液等体积混合,充分反应后,溶液中存在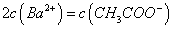 ,则该混合溶液中醋酸的电离常数Ka=______________________(用含a和b的代数式表示)。
,则该混合溶液中醋酸的电离常数Ka=______________________(用含a和b的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
在盛有50 mL澄清饱和石灰水的小烧杯中放入一小块钠,不可能观察到的现象是
 A.钠熔化成银白色小球 B.在液面快速游动
A.钠熔化成银白色小球 B.在液面快速游动
























 C.溶液底部出现光亮的银白色固体 D.溶液变浑浊
C.溶液底部出现光亮的银白色固体 D.溶液变浑浊
查看答案和解析>>
科目:高中化学 来源: 题型:
实 验室中,用如下图所示装置及所给药品(图中部分夹持仪器已略去)探究工业制硫酸接触室中的反应,并测定此条件下二氧化硫的转化率。已知:SO3熔点为
验室中,用如下图所示装置及所给药品(图中部分夹持仪器已略去)探究工业制硫酸接触室中的反应,并测定此条件下二氧化硫的转化率。已知:SO3熔点为
16.8℃,假设气体进入装置时分别被完全吸收,且忽略装置内空气中的CO2。
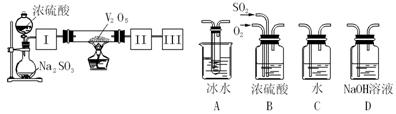
(1)已知0.5molSO2被O2氧化成气态SO3,放出49.15 kJ热量,此反应的热化学方程式为 ;
(2)根据实验目的,请从上面右图中选择Ⅰ、Ⅱ、Ⅲ处合适的装置,并将其字母填入空格中:装置Ⅰ ,装置Ⅱ ;
(3)开始进行实验时,首先应进行的操作是 ;
(4)停止通入SO2,熄灭酒精灯后,为使残留在装置中的SO2、SO3尽可能被充分吸收,操作方法是 ;
(5)实验结束后,若装置Ⅱ增加的质量为b g ,装置Ⅲ增加的质量为a g,则此条件下二氧化硫的转化率是: ×100%(用含字母的最简代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com