
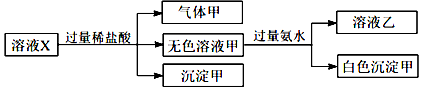
| A. | 气体甲一定是纯净物 | |
| B. | 沉淀甲是硅酸和硅酸钙的混合物 | |
| C. | Na+、AlO2-和SiO32-一定存在于溶液X中 | |
| D. | CO32-和SO42-一定不存在于溶液X中 |
分析 由实验可知,X与过量盐酸反应生成沉淀为硅酸,气体为二氧化碳,则X中一定含SiO32-、CO32-,甲与氨水反应生成沉淀为氢氧化铝,则X中含AlO2-,结合离子共存及电荷守恒来解答.
解答 解:由上述分析可知,X中一定含AlO2-、SiO32-、CO32-,SiO32-、CO32-均与Ca2+、Fe3+反应不能共存,则X中不含Ca2+、Fe3+,由电荷守恒可知,阳离子一定为Na+,
A.甲一定含二氧化碳,可能含HCl,不一定为纯净物,故A错误;
B.沉淀甲是硅酸,故B错误;
C.由上述分析可知,Na+、AlO2-和SiO32-一定存在于溶液X中,故C正确;
D.CO32-一定存在于溶液X中,不能确定是否含SO42-,故D错误;
故选C.
点评 本题考查常见离子的检验,为高频考点,把握离子之间的反应和现象为解答的关键,侧重分析与实验能力的考查,注意元素化合物与实验的结合,题目难度不大.


 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源: 题型:选择题
| A. | 2.1g | B. | 3.6g | C. | 7.2g | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
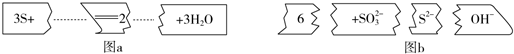
| A. | 配平后的化学计量数依次为3、1、2、6、3 | |
| B. | 若有1 mol S被氧化,则生成2 mol S2- | |
| C. | 氧化剂与还原剂的物质的量之比为1:2 | |
| D. | 2 mol S参加反应有3 mol电子发生转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烷的二氯代物和丙烷的一氯代物 | |
| B. | 正丁烷的一氯代物和异戊烷的一氯代物 | |
| C. | 新戊烷的一氯代物和C(CH2CH3)4的一氯代物 | |
| D. | C2H6的五氯代物和C5H8属于炔烃的同分异构体数目 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com